
A veces, los detalles aparentemente insignificantes tienen un impacto increíble en la imagen general. Este principio es aplicable a muchas áreas de nuestra vida: la sonrisa misteriosa de Mona Lisa, que dio lugar a muchas teorías y especulaciones; una línea de código que puede cambiar completamente la funcionalidad del programa; El orden de disposición de los átomos, que cambia las propiedades de una sustancia. Hablaremos de esto último hoy. Los científicos de la Universidad de Tsukuba (Japón) han presentado una teoría según la cual es posible crear una nueva estructura de diamante, que será más difícil que el mineral conocido. Los científicos llamaron a su creación "diamante penta". ¿Qué se necesita para crear un diamante penta, qué propiedades puede poseer y dónde se puede usar una sustancia tan inusual? Encontraremos respuestas a estas preguntas en el informe de los científicos. Vamos.
Base de estudio
El carbono es un elemento ubicuo en la tabla periódica y es la base de una gran variedad de compuestos orgánicos e inorgánicos. En la naturaleza, el carbono se puede encontrar en casi todas partes: aceite y turba, metano y dióxido de carbono, músculos y huesos, etc. etc. En resumen, el carbono se considera uno de los principales componentes básicos de la vida en la Tierra por una razón.
Ciertas sustancias o elementos químicos pueden existir en diferentes formas bajo diferentes condiciones. Esto se llama alotropía. El carbono es el poseedor del récord en este negocio, ya que tiene más de 9 modificaciones alotrópicas.
Las razones de la presencia de una cantidad tan grande de alótropos de carbono son la hibridación orbital, las condiciones límite y los defectos topológicos. Tres formas de hibridación orbital (sp, sp 2 y sp 3) representan alótropos que cubren todas las dimensiones:
- cadenas unidimensionales para sp (polino);
- hoja bidimensional para sp 2 (grafeno);
- Malla 3D para sp 3 (diamante).
Además, las condiciones límite y los defectos topológicos permiten que el carbono forme alótropos adicionales con morfologías únicas: por ejemplo, nanotubos de carbono y fullereno, que tienen propiedades electrónicas y estructurales inusuales.
Una variedad de fullerenos.
Los alótropos de carbono, que consisten en átomos de sp 2 y sp 3 C, atraen la atención de los investigadores debido a su diversidad morfológica, que se debe a la gran cantidad de combinaciones de átomos de sp 2 y sp 3 dentro de un sistema. Un ejemplo de esto son los fullerenos tratados con alta presión y temperatura (por ejemplo, C 60), que puede tener una baja densidad de masa debido a enlaces covalentes entre fullerenos y poros de tamaño nanométrico.
Además, existen estudios que describen el enfriamiento rápido del carbono amorfo, lo que conduce a la formación de un carbono híbrido alótropo sp 2 -sp 3 -Q , que tiene un magnetismo y una dureza superior al diamante.
El carbono puede llamarse aproximadamente plastilina en manos de los científicos, porque a partir de él se pueden crear muchas sustancias con diferentes propiedades y funcionalidades, habría deseo y fantasía.
En este trabajo, los científicos presentaron un estudio teórico de un alótropo de carbono tridimensional, que consta de átomos C sp 2 y sp 3(penta diamante). Se puede obtener por copolimerización de moléculas de hidrocarburos que contienen anillos pentagonales (espiro [2.4] heptano-4.6-dieno (C 7 H 8 ) y [5.5.5.5] -fennestran-tetraína).
El diamante Penta consiste en anillos pentagonales con el grupo espacial Fm¯3m debido a la copolimerización de estas moléculas constituyentes. Los cálculos han demostrado que el diamante penta tiene un módulo de alto volumen * - 381 GPa, que es aproximadamente el 80% del diamante. Esto sugiere que el diamante penta es un alótropo de carbono sólido.
Además, tiene una relación de Poisson negativa * (-0.241), lo que conduce a un módulo de Young * extremadamente alto (1691 GPa) y un módulo de corte * (1113 GPa), que es más alta que la del diamante u otros carbonos ultrarresistentes.
Módulo de elasticidad a granel * : una característica de la capacidad de una sustancia para resistir la compresión general.
Relación de Poisson * : la relación entre la compresión lateral relativa y la tensión longitudinal relativa.
Módulo de Young * (módulo de elasticidad): una evaluación de la capacidad de un material para resistir la tensión, compresión bajo deformación elástica.
Módulo de corte * : una evaluación de la capacidad del material para resistir la deformación de corte.El diamante Penta es un semiconductor con un intervalo de banda indirecto * de 2.25 eV, que se espera que tenga una gran movilidad de orificios * .
* — , .
* — .
Todos los cálculos se realizaron sobre la base de la teoría funcional de densidad implementada en el paquete de software STATE ( STF-ElectronMo ).
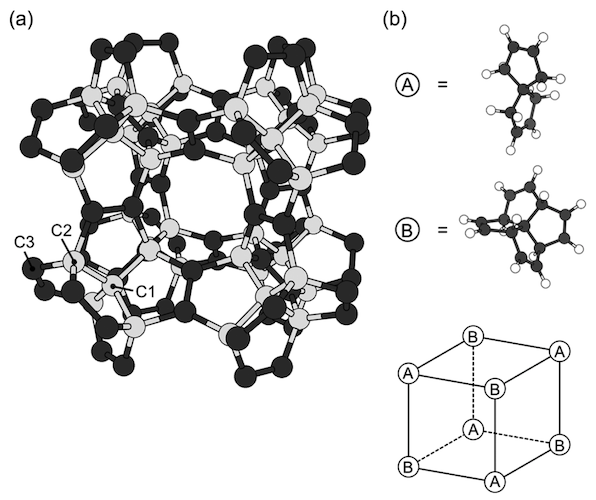
Imagen # 1
Los diagramas anteriores muestran la geometría optimizada de un pentágono con un parámetro de red de 9.195 Å y el grupo espacial Fm¯3m. La red covalente consiste exclusivamente en pentágonos, en los que tres de los cinco bordes están separados por pentágonos vecinos ( 1a ), debido a la copolimerización de C 7 H 8 y [5.5.5.5] -fennestrano-tetraína, que se ubican alternativamente en los vértices de la red cúbica ( 1b ).
Según estas moléculas constituyentes y su disposición, la célula unitaria de un diamante peta contiene 22 átomos de carbono: 10 son sp3 y 12 - por sp 2 átomos . Además, los operadores de simetría que pertenecen al grupo Fm¯3m reducen el número de regiones atómicas independientes a tres.
Dado que la red está compuesta por átomos de carbono sp 2 (triple coordinado) y sp 3 (cuádruple coordinado), los enlaces covalentes se clasifican en dos grupos. Las longitudes de enlace calculadas relacionadas con los átomos de sp 3 son 1.563 Å para enlaces C1-C1 y 1.520 Å para C2-C3. Pero la longitud del enlace (C3-C3) para los átomos sp 2 es 1.349 Å, lo que confirma la presencia de un doble enlace en los átomos sp 2 .
Como se muestra en 1a, el diamante penta tiene grandes "poros" cúbicos con 3.664 Å bordes, rodeados por una red pentagonal covalente. En consecuencia, tiene una baja densidad de masa con una densidad de 2,26 g / cm 3 , como el grafito, pero un 36% menos que el diamante.
La energía total relativa de un diamante penta es 275 meV / átomo, que corresponde a un diamante clásico. Pero la energía total es más alta que la del diamante, el grafito y otros materiales de carbono duro, aunque más baja que la del C60, que se sabe que es un alótropo de carbono metaestable de espacio cero. La energía total moderada se explica por la distorsión estructural de los ángulos de enlace para los átomos sp 2 y sp 3 .
Con respecto a los átomos sp 3 : a pesar de que el átomo C1 tiene una sp casi perfecta3 hibridación con un ángulo de enlace θ212 = 109.4 °, el átomo de C2 tiene ángulos de enlace θ212 = 115.9 ° y θ323 = 101.9 °, que son más anchos y estrechos que los ángulos de enlace correspondientes de sp 3 ideal . Con respecto a los átomos sp 2 : debido a la red pentagonal, el ángulo de enlace relacionado con C3 es θ232 = 133.4 ° y θ233 = 113.3 °, que también es más grande y más pequeño que los ángulos de enlace correspondientes para sp 2 ideal .
Energía moderada también aumenta la energía de formación (? E) de diamante penta sobre copolimerización directa de C 7 H 8 y [5.5.5.5] -phenestran-tetraine:
spironadien + fenestratetraene = penta diamante + 12H 2 + ΔELa energía de formación calculada es 0,31 eV / átomo, lo que refleja el consumo de energía para la formación de una red covalente de átomos de carbono sp 2 y sp 3 con ángulos de enlace distorsionados.
Por lo tanto, se espera que el diamante penta se sintetice usando la reacción de Ullmann para bromospiro [4.4] nona-2.7-dieno y bromo [5.5.5.5] -fennestratetraeno en lugar de su forma primaria.
A continuación, se realizó un estudio de la estabilidad térmica del penta diamante modelando la dinámica molecular a una temperatura de 4000 K.Para comprender qué cambios estructurales pueden ocurrir, se realizaron cálculos de dinámica molecular con una temperatura constante para una celda atómica expandida (88 átomos de carbono) durante 12 ps (picosegundos, 1 ps = 10-12 s) y para uno simplificado (1x1x1) para 146 ps.
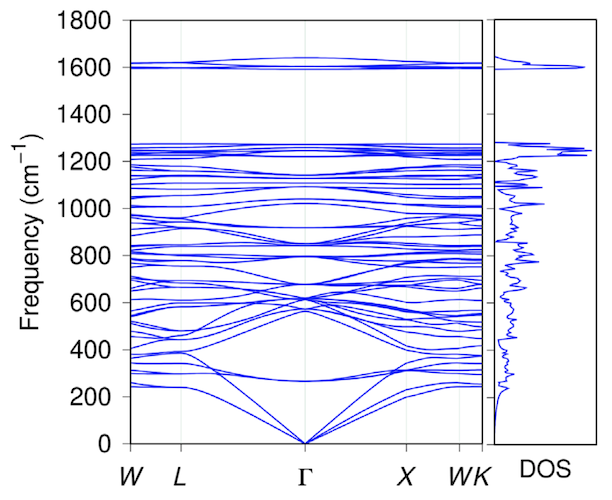
Imagen # 2
Según los resultados de la simulación después de 14 ps a 4000 K, el diamante penta retiene por completo su topología original tanto en la célula atómica compleja como en la célula atómica simplificada (gráfico de arriba).
En consecuencia, el penta diamante es térmica y energéticamente estable si se sintetiza utilizando los esquemas apropiados propuestos en este trabajo.
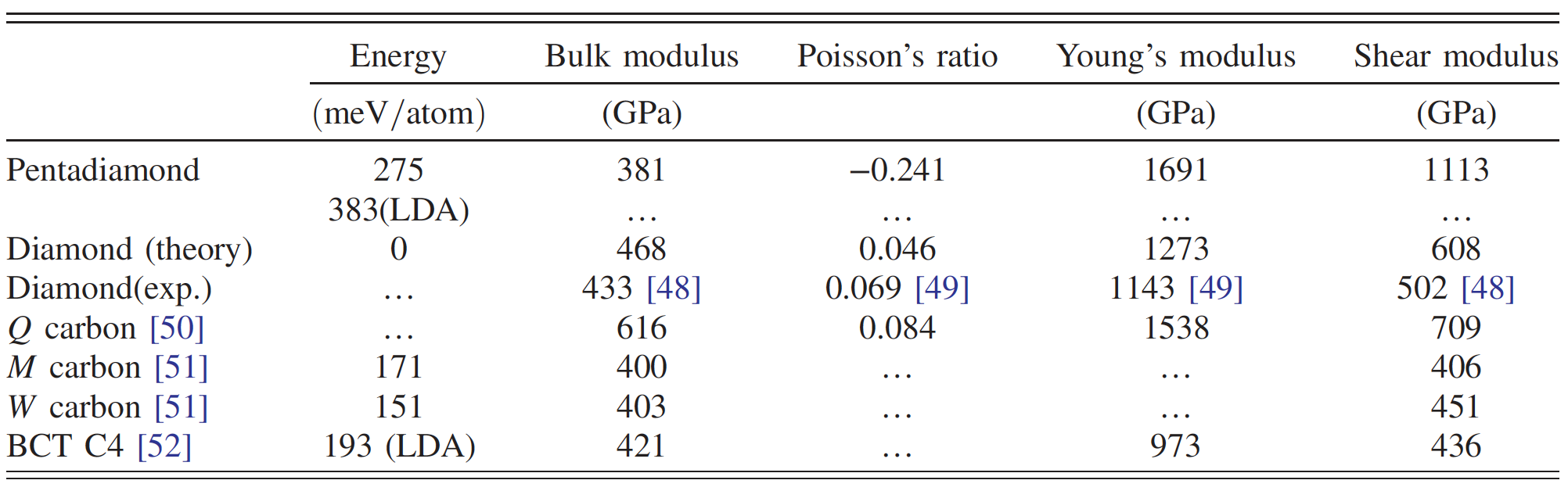
Comparación de las propiedades del diamante penta y otros alótropos de carbono.
Las propiedades mecánicas del diamante penta se estudiaron mediante constantes elásticas cij, que se determinan evaluando la diferencia finita en la energía total con respecto a las deformaciones. Los valores calculados de las constantes elásticas fueron: 1715.3 GPa para s 11 (= s 22 = s 33 ); −283.5 GPa para s12 (= s 13 = s 23 ) y 1187.5 GPa para s 44 (= s 55 = s 66 ).
También debe tenerse en cuenta que estos indicadores satisfacen completamente el criterio de estabilidad de Born (con 11 - con 12 > 0, con 11 + 2c 12 > 0 y con 44 > 0), que además indica la estabilidad del penta diamante.
En el caso de la simetría cúbica, el módulo de elasticidad aparente se calcula mediante la fórmula: B = (s 11 + 2s 12) / 3. Como resultado, B fue igual a 381 GPa, que es más del 80% de la cifra correspondiente para el diamante. Esto sugiere que el diamante penta es un candidato potencial para los alótropos de carbono sólido, aunque su densidad es bastante baja (como la del grafito).
Para una mayor investigación de las propiedades mecánicas, el módulo de Young de penta-diamante se calculó utilizando la fórmula:
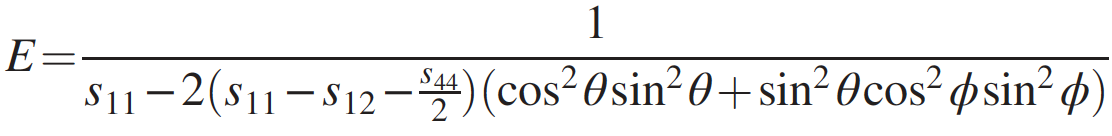
donde θ y ϕ son los ángulos de Euler * , s ij es el cumplimiento elástico determinado por cij con las relaciones entre s 11 = [c 11 + c 12 ] / [(c 11 - c 12 ) (c 11 + 2c 12 )], s 12 = [-c 12 ] / [(c 11- c 12 ) (c 11 + 2c 12 )] ys 44 = 1 / c 44 .
Ángulos de Euler * : ángulos que describen la rotación de un cuerpo absolutamente rígido en un espacio tridimensional.
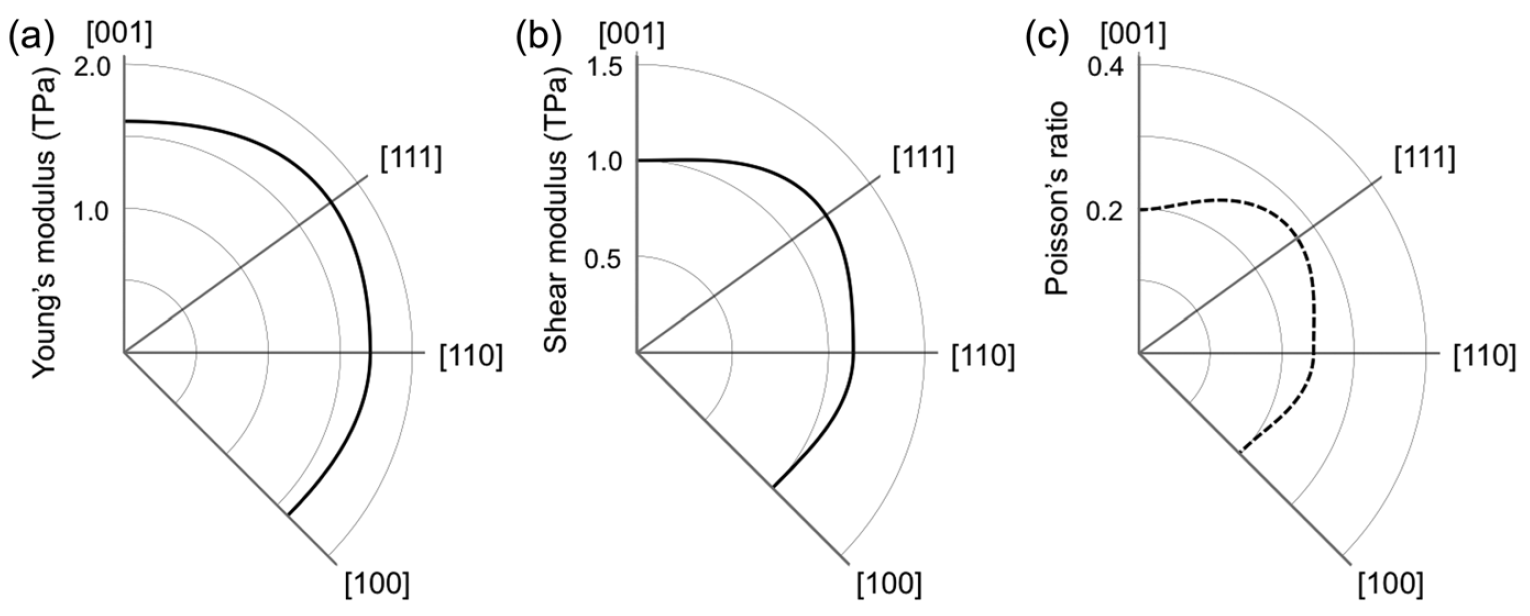
Imagen No. 3
El módulo de Young de penta diamante es extremadamente alto y excede 1.5 TPa para todas las direcciones ( 3a ). Conociendo el módulo de elasticidad y el módulo de elasticidad de Young, es posible calcular el módulo de corte ( 3b ), que también resultó ser bastante alto (1 TPa) para todas las direcciones.
En consecuencia, el diamante penta puede exhibir una rigidez extrema en relación con las deformaciones estructurales anisotrópicas. El hecho de que el módulo de Young y el módulo de corte sean más altos que el de otros alótropos de carbono duros y superduros (tabla anterior) también requiere atención especial.
Tales valores altos de los módulos descritos anteriormente indican que el diamante penta debería tener una relación de Poisson negativa. Esta afirmación fue confirmada por cálculos que muestran la relación de Poisson en el rango de -0.20 a -0.28, dependiendo de las direcciones de la rejilla ( 3c ). Estos indicadores únicos conducen al hecho de que la velocidad del sonido en penta diamante también será bastante alta (28700 m / s frente a 12000-18350 m / s para el diamante ordinario).
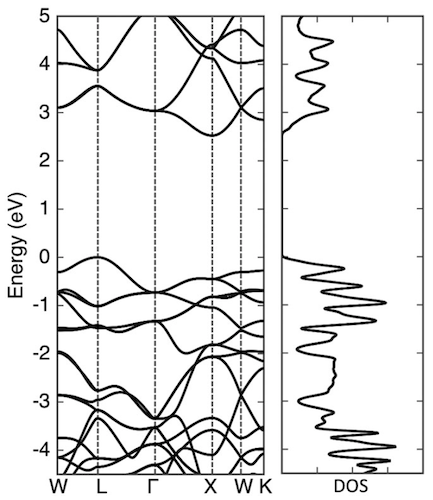
Imagen No. 4
El gráfico anterior muestra la estructura electrónica y la densidad de los estados del penta diamante, que es un semiconductor con un intervalo de banda indirecto de 2,52 eV. Las bandas de valencia y conducción se ubican en los puntos L y X, respectivamente. La rama más alta de la banda de valencia y la rama más baja de la banda de conducción tienen una dispersión significativa (1 eV o más).
Por lo tanto, se espera que el diamante penta tenga pequeñas masas efectivas en los bordes de las bandas: las masas calculadas de electrones en el punto X son 0.98 y 0.67 (menos que la del diamante) a lo largo de las direcciones a los puntos Γ y W, respectivamente. Pero con respecto al borde de la banda de valencia, la situación es la opuesta: las masas calculadas de agujeros en el punto L son 1.59 y 0.76 (mayor que la del diamante) a lo largo de las direcciones a los puntos W y Γ, respectivamente.
La masa portadora moderada y la alta densidad de estados en los bordes de la banda sugieren que el diamante penta puede tener una movilidad portadora moderada tanto para un electrón como para un agujero. La relación de dispersión, así como la densidad de estado, muestran que el diamante penta tiene una estructura electrónica volumétrica tridimensional, como la de un diamante, que refleja su red covalente tridimensional con alta simetría.
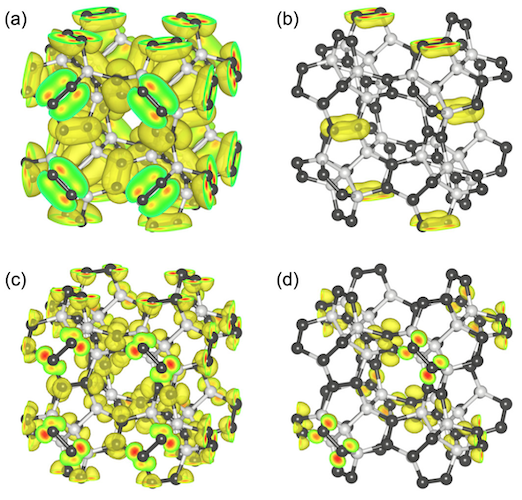
Imagen №5
Para una mejor comprensión de la estructura electrónica del diamante penta, los científicos realizaron un estudio de la función de onda de la rama más alta y la rama más baja del diamante penta en ciertos puntos de simetría.
Las funciones de onda de la rama superior de la banda de valencia en los puntos L y Γ se distribuyen sobre los átomos de C3, que tienen el carácter de un enlace π, debido a su sp 2-hibridación. La función de onda de la rama inferior de la banda de conducción en los puntos Γ y X también se distribuye sobre los átomos de C3 con una naturaleza π antienvejecimiento. Los científicos señalan que tanto el estado de valencia como el estado de conducción no son un estado π puro, sino estados hibridados que contienen una pequeña cantidad del componente σ. Esto significa que los estados electrónicos cerca y alrededor de los bordes de la banda se consideran estados electrónicos π de los dímeros sp 2 C, que están aproximadamente a 2.6 Å de distancia de sus ocho regiones adyacentes.
Para un conocimiento más detallado de los matices del estudio, le recomiendo que consulte el informe de los científicos .
Epílogo
En este estudio, los científicos han avanzado la teoría de que es posible crear una estructura de carbono con mejores propiedades que el diamante. Los cálculos realizados durante el estudio confirmaron esta conjetura.
Mediante la copolimerización de espiro [2.4] heptano-4.6-dieno (C 7 H 8 ) y [5.5.5.5] -fenestrano-tetraína con simetría Fm¯3m, se puede sintetizar una red pentagonal covalente tridimensional de átomos de carbono sp 2 y sp 3 . Los científicos llamaron a su creación un penta diamante.
La mayoría de las propiedades mecánicas del diamante penta son superiores a las del diamante convencional conocido por nosotros u otros alótropos de carbono duro. Curiosamente, el diamante penta es más duro que el diamante, pero su densidad es similar a la del grafito.
En el futuro, los científicos tienen la intención de traducir la teoría a la práctica. Pero incluso ahora, su trabajo demuestra claramente que las posibilidades de la ciencia moderna son realmente infinitas, si, por supuesto, prestas la debida atención a los detalles, recuerdas todos los matices de las leyes de la naturaleza y no temes experimentar.
Viernes off-top:
BBC , . ( , )
BBC , . ( , )
Fuera de la parte superior 2.0:
, , ? , , .. - …
, , ? , , .. - …
¡Gracias por su atención, tengan curiosidad y tengan un excelente fin de semana, chicos! :)
Un poco de publicidad
Gracias por estar con nosotros. ¿Te gustan nuestros artículos? ¿Quieres ver más contenido interesante? Apóyenos haciendo un pedido o recomendando a amigos, VPS en la nube para desarrolladores desde $ 4.99 , un análogo único de servidores de nivel de entrada, que inventamos para usted: toda la verdad sobre VPS (KVM) E5-2697 v3 (6 núcleos) 10GB DDR4 480GB SSD 1Gbps desde $ 19 o cómo dividir el servidor? (las opciones están disponibles con RAID1 y RAID10, hasta 24 núcleos y hasta 40GB DDR4).
Dell R730xd es 2 veces más barato en el centro de datos Equinix Tier IV en Amsterdam? ¡Solo tenemos 2 x Intel TetraDeca-Core Xeon 2x E5-2697v3 2.6GHz 14C 64GB DDR4 4x960GB SSD 1Gbps 100 TV desde $ 199 en los Países Bajos!Dell R420 - 2x E5-2430 2.2Ghz 6C 128GB DDR3 2x960GB SSD 1Gbps 100TB - ¡Desde $ 99! Lea sobre Cómo construir la infraestructura de bldg. clase c con servidores Dell R730xd E5-2650 v4 que cuestan 9,000 euros por un centavo?