
La diversidad visual de los seres vivos en el planeta Tierra no se debe tanto al ansia de belleza y al deseo de ser diferente, sino al hábitat, los hábitos e incluso las preferencias gastronómicas. Alguien prefiere pasar desapercibido, fusionándose con el entorno debido al color del camuflaje y la forma inusual del cuerpo. Alguien, por el contrario, con toda su apariencia le habla a cualquiera que se atreva a acercarse, sobre su veneno. Y a alguien le encanta presumir frente a un compañero y pisotear a un competidor en el barro. Cualquier característica visual tiene alguna función. Por ejemplo, el color del pez payaso de la especie Amphiprion percula, que se hizo mundialmente famosa gracias a la caricatura "Buscando a Nemo", está asociada a su territorialidad. Así que los científicos del Instituto de Ciencia y Tecnología de Okinawa (Japón) decidieron averiguar cómo y dónde los peces payaso obtienen sus marcas de rayas blancas en el cuerpo. Cuando los peces payaso muestran sus rayas, ¿qué mecanismos están involucrados en esto y qué tienen que ver las anémonas con eso? Encontraremos respuestas a estas preguntas en el informe de los científicos. Ir.
Base de investigación
El pez payaso es un género de peces marinos con aletas radiadas de la familia pomacentral, que cuenta con unas 30 especies que habitan los arrecifes de los océanos Índico y Pacífico.
Los peces payaso, a pesar de su mal genio, no son ajenos al trabajo en equipo.
Una de las características más famosas de estos peces es su relación simbiótica con las anémonas (anémonas), organismos del orden de los pólipos de coral que escapan. Parecen un manojo de tentáculos (Cthulhu aprueba) con o sin una pierna unida al suelo marino sólido. Las anémonas llevan un estilo de vida sedentario y se alimentan de lo que, por su estupidez o por la coincidencia de circunstancias, cae en sus tentáculos. Sin embargo, no será posible ver ataques agudos o cualquier otro ataque, porque las anémonas matan (o paralizan) a sus presas con la ayuda de células urticantes (cnidocitos). La víctima paralizada (en el mejor de los casos, ya muerta) es luego transferida por tentáculos a la boca de la anémona.
Pero el pez payaso, mirando las anémonas, no ve peligro, sino alojamiento gratuito. Los tentáculos de las anémonas están cubiertos de moco, protegiéndolos de la acción de sus propias células urticantes. Los peces payaso también están cubiertos de este moco, lo que los hace inmunes a los cnidocitos mortales. Los peces usan las anémonas como hogar e incluso como fuente de alimento (restos de comida de las anémonas, tentáculos caídos, secreciones). A cambio, limpian las anémonas de escombros, comida no digerida y conducen agua a través de sus tentáculos, proporcionando "ventilación".

Muchas especies de peces payaso son extremadamente celosos de sus anémonas, ahuyentando a cualquiera que se acerque a una distancia que consideren "sospechosa". Es decir, a pesar de su nombre gracioso, estos peces no se comportan como los simpáticos payasos de la Licedea tetra, sino como Pennywise.
Muchos científicos asocian el color del pez payaso y su territorialidad. Sin embargo, hasta ahora no se sabía cómo se forma ese color. En particular, los científicos siempre han estado desconcertados por las tres franjas blancas en el cuerpo de los adultos, lo que no ocurre con los jóvenes. Esto indica que durante su vida los peces sufren algún tipo de metamorfosis. Queda por saber cuáles.
Los científicos señalan que la principal tarea de la biología es comprender la especiación. Pero esto no se limita a comprender la diferencia entre especies (en términos exagerados), sino también a comprender las causas y los mecanismos que causan diferencias dentro de una especie, ya sean fisiológicas o de comportamiento.
La diversidad dentro de una sola especie se puede expresar como variaciones fenotípicas entre poblaciones individuales. Pero incluso dentro de una población separada, puede haber diferencias causadas por la influencia del entorno, las características del comportamiento o las condiciones del desarrollo.
En algunos casos, la variabilidad fenotípica puede reflejar la plasticidad del desarrollo adaptativo, es decir, la capacidad de los organismos para cambiar sus trayectorias de desarrollo para crear fenotipos que se adapten con precisión a las condiciones ambientales. Un ejemplo de tal plasticidad es el color variado en animales de la misma especie.
En palabras, parece bastante simple, pero de hecho, tales cambios plásticos están asociados con cambios complejos a nivel fisiológico, celular y molecular. Los científicos admiten honestamente que, aunque la ciencia conoce la plasticidad, los mecanismos subyacentes a ella prácticamente no se estudian.
En este sentido, vale la pena señalar otro proceso importante e inusual que ocurre durante el desarrollo de algunos organismos: la metamorfosis. Este proceso se debe a cambios serios en la estructura del cuerpo (o parte de él) en el curso del desarrollo individual. La metamorfosis está regulada por hormonas tiroideas (TH de hormonas tiroideas). En consecuencia, cualquier cambio en la HT durante la metamorfosis provocada por estas hormonas puede afectar tanto al proceso como al resultado de un proceso tan complejo de transformación del organismo. La TH también juega un papel importante en la transición de la pigmentación de larva a adulto. Por ejemplo, en el pez cebra ( Danio rerio ), la TH promueve la maduración de células pigmentarias específicas, melanóforos negros y xantóforos amarillos.

A Danio rerio también se le llama calcetín de dama (quien decía que los ictiólogos no tienen sentido del humor).
Por lo tanto, existe una alta probabilidad de que se observe un patrón similar en el pez payaso. En el trabajo que estamos considerando hoy, los científicos decidieron probar la relación entre la TH y la metamorfosis del color del pez payaso, y también consideraron la posible influencia del hábitat (dos especies diferentes de anémonas) en este proceso.
El estudio se centra en especies estrechamente relacionadas Amphiprion ocellaris y Amphiprion percula , que viven en simbiosis con anémonas en la región tropical del Indo-Pacífico. Los científicos han encontrado que las A. percula jóvenes demuestran diferentes tasas de formación de rayas blancas según la especie de anémonas donde viven: en las anémonas de la especie Stichodactyla gigantealas rayas aparecen más rápido y más lento en la anémona de mar Heteractis magnifica . En consecuencia, la formación de rayas (es decir, ciertos cambios metamórficos) está influenciada no solo por factores internos (hormonas tiroideas), sino también por factores externos (hábitat).
Resultados de la investigacion

Durante el desarrollo postembrionario, los individuos de Amphiprion gradualmente adquieren rayas en la cabeza, el tronco y el pedúnculo caudal. En Kimbe Bay, Papua Nueva Guinea, A. percula se encuentra en dos especies diferentes de anémonas: S. gigantea y H. magnifica , pero los peces que viven allí pertenecen a la misma población.
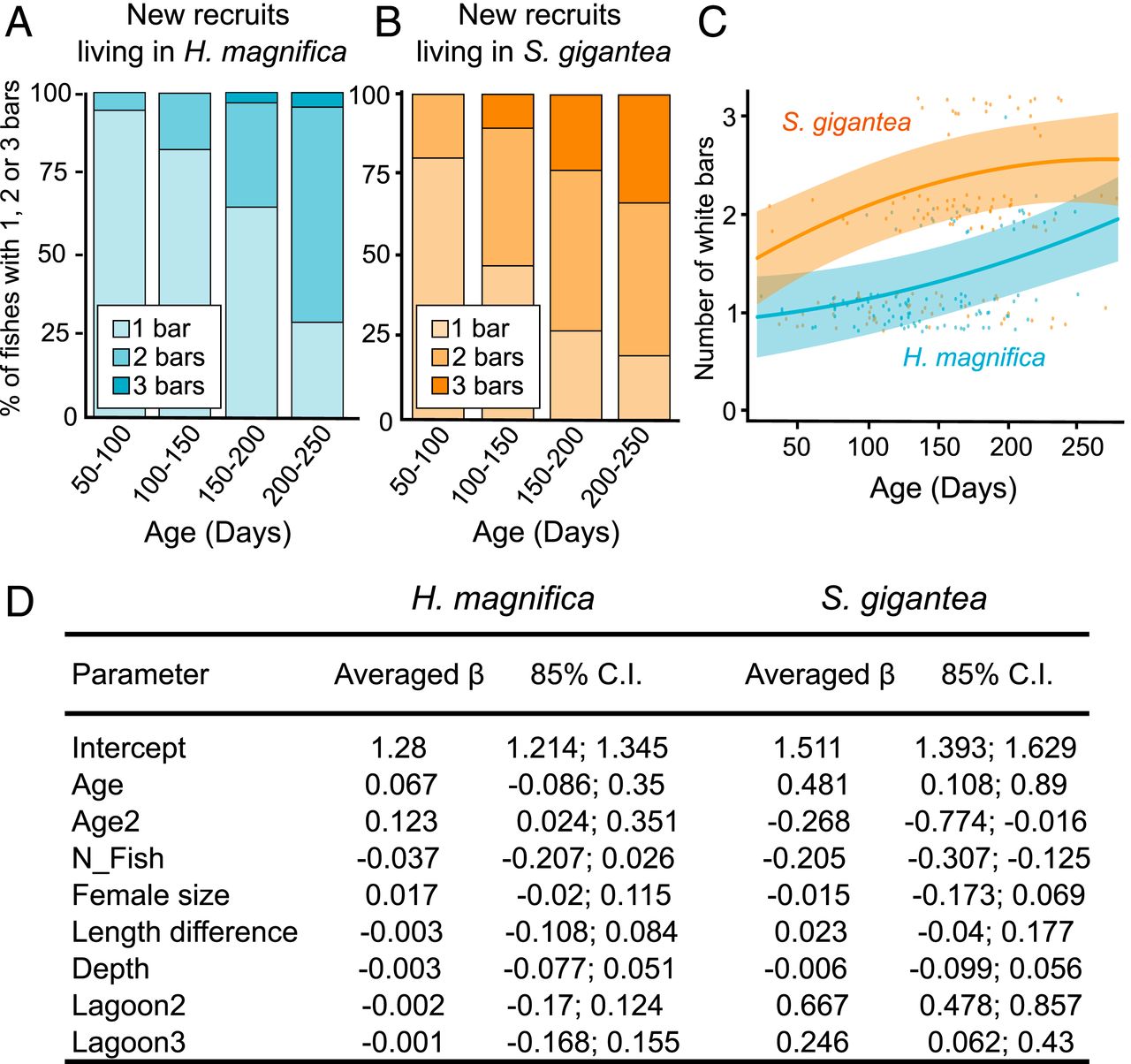
Imagen # 1
Sin embargo, la A. percula joven que vive en la anémona de mar S. gigantea tiene más rayas blancas que la A. percula joven que vive en la anémona de mar H. magnifica . En el 33% de 148 individuos (200 a 250 días de edad) en anémonas S. gigantea tenía tres franjas blancas, mientras que sólo el 5% de 118 individuos de la misma edad en H. magnifica tenía tres franjas ( 1A y 1B ).
Las observaciones sugieren que las especies de anémonas (es decir, el hábitat) afectan el momento de la formación de rayas blancas en A. percula joven . El análisis de regresión múltiple ayudó a comprobar la exactitud de esta afirmación, lo que permitió establecer la dependencia de una variable de dos o más variables independientes. Como era de esperar, el análisis confirmó que los juveniles que viven en S. gigantea siempre tenían más rayas que los individuos de la anémona de mar H. magnifica( 1C y 1D ).
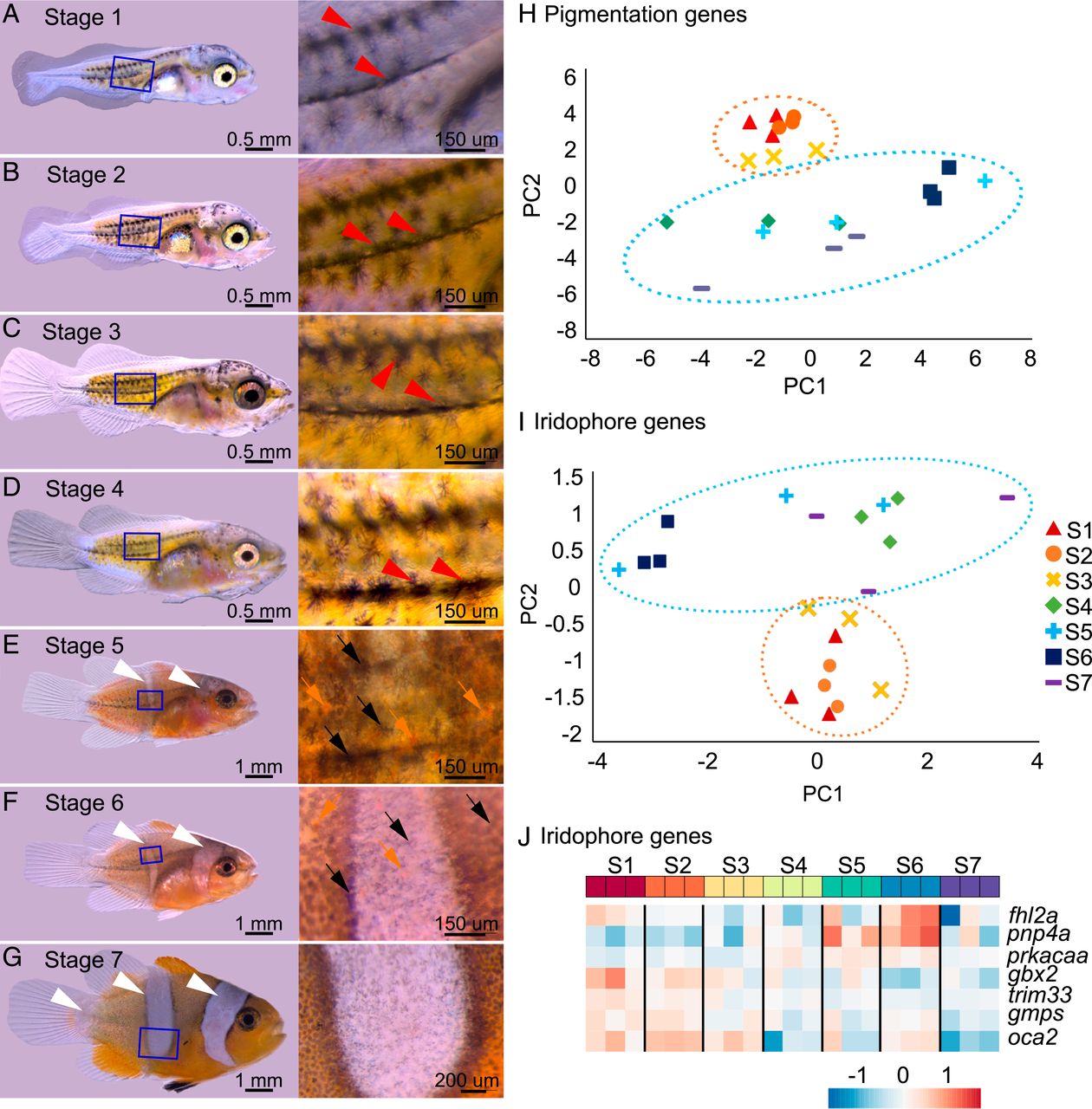
Imagen №2 La
formación de rayas está directamente relacionada con el proceso de desarrollo postembrionario, en particular con la metamorfosis. Por lo tanto, al rastrear las etapas de este proceso, es posible establecer una conexión entre las bandas y el nivel de hormonas tiroideas (TH).
La vista A. ocellaris muestra dos esquemas de pigmentación en el desarrollo del tiempo antes del paso №5 (aproximadamente 9 días después de la eclosión), las larvas tienen una ksantofory * amarilla con un conjunto de melanóforos estrella que forman dos franjas horizontales que cubren los miotomas * (rojo flechas en el 2A- 2D ).
Cromatóforos * : células que contienen pigmentos o que reflejan la luz, divididas en subclases según el color:
xantóforos: amarillo;
eritróforos - rojo;
leucoforos - blanco;
melanóforos - negro / marrón;
cianóforos - azul;
iridóforos - plateado.
Miotome * es un rudimento emparejado de músculos esqueléticos en los embriones de cordados.A partir de la quinta etapa, las larvas adquieren tres franjas verticales blancas (flechas blancas en 2E - 2G ), xantóforos naranjas fuera de las futuras franjas blancas (flechas naranjas en 2E) y melanóforos distribuidos por todo el cuerpo (flechas negras en 2E y 2F ) . Estos melanóforos están presentes en todo el cuerpo y tienen una mayor densidad en el borde de las franjas blancas ( 2F y 2G ).
Para una mejor comprensión de los cambios en el patrón en el cuerpo de los individuos que ocurren en la cuarta etapa, fue necesario evaluar la expresión de genes de pigmentación en las etapas postembrionarias. Para ello, se extrajo ARN de las larvas en cada etapa de desarrollo para el análisis del transcriptoma. Se hizo especial hincapié en el estudio de los genes de pigmentación ( 2H ), en particular de los genes iridóforos, ya que son los responsables de la formación de rayas blancas.
Se encontró que las etapas 1-3 son sorprendentemente diferentes de las etapas 4-7 en el componente principal 2 (PC2; 2H y 2I ).
(PCA principal component analysis) — , .Entre los genes relacionados con PC2, los genes fhl2b, pnp4a y prkacaa fueron más pronunciados en las etapas 5-7 en comparación con las etapas 1-3. Por otro lado, los genes gbx2, trim33, gmps y oca2 fueron más pronunciados en las etapas 1-3 en comparación con las etapas 5-7 ( 2J ).
Además, durante el análisis, se observó una clara división de etapas para todas las categorías funcionales: especificación de células pigmentarias, desarrollo de xantóforos, síntesis de pigmento pteridina de xantóforos, desarrollo de melanóforos, regulación de la melanogénesis y biogénesis de melanosomas.
Estas observaciones sugieren que en la cuarta etapa hay un cambio importante en el desarrollo del color, que involucra a los tres tipos de células pigmentarias.
Teniendo en cuenta que las hormonas tiroideas (TH) desempeñan un papel importante en el proceso de metamorfosis, que controla el patrón de pigmentación en muchos peces teleósteos, es lógico que TH regule el momento en que se forman las rayas blancas durante la metamorfosis del pez payaso.
Para probar esta hipótesis, se llevaron a cabo pruebas en las que las larvas de la tercera etapa de desarrollo fueron expuestas a diversas concentraciones (10 -6 , 10 -7 y 10 -8 M) de la hormona tiroidea activa T3. Tres días después del tratamiento con T3, los sujetos mostraron una aparición más temprana de rayas blancas que los individuos del grupo de control.

Imagen No. 3
Este efecto de aceleración dependía de la dosis de T3. Tres días después, aparecieron dos bandas en la siguiente proporción de sujetos experimentales: 0% - grupo de control; 50% - a 10 -8 M T3; 78% - a 10 -7 M y 73% - a 10-6 M ( 3A - 3E ).
Luego se realizó una prueba similar, pero con el bloqueo de TH mediante una mezcla de MPI (metimazol, perclorato de potasio y ácido iopanoico). Las larvas tratadas de la tercera etapa de desarrollo mostraron un retraso de nueve días en la formación de rayas blancas en comparación con el grupo de control (grupo de prueba a las 3H y grupo de control a las 3G). Aproximadamente el 75% de los individuos del grupo de control tenían rayas en la cabeza y el cuerpo, del grupo de prueba solo el 15% de los individuos tenían rayas, el resto se quedó sin pigmentación ( 3F ). Se formaron franjas blancas en los peces del grupo de prueba a pesar del bloqueo de TH, pero solo después de 25 días ( 3I ).
Las manipulaciones con TH también afectaron a las células pigmentarias. El número de melanóforos aumentó significativamente dentro de las 48 horas posteriores a la aplicación de 10-6 M T3 ( 3J ). Por otro lado, el bloqueo de la TH con MPI condujo a una disminución casi imperceptible del número de melanóforos 48 y 72 horas después del tratamiento ( 3J ).
En conjunto, los resultados de estas pruebas sugieren que la TH controla el momento de la formación de rayas blancas y también afecta a las células pigmentarias (iridóforos y melanóforos).
Para determinar con mayor precisión cómo afecta exactamente la TH a los iridóforos, analizamos la expresión de los genes de los iridóforos (fhl2a, fhl2b, apoda.1, saiyan y gpnmb) después del tratamiento de las larvas con TH exógena.
Las larvas de la tercera etapa de desarrollo se trataron con T3 a diversas concentraciones (10-6, 10-7 y 10-8 M) durante 12, 24, 48 y 72 horas. La expresión de los genes estudiados se controló mediante nanocadenas en ARN aislado de larvas enteras.
Después del tratamiento con T3, se detectaron muchas más transcripciones de estos genes que en el grupo de control (sin tratamiento con T3). En algunos casos (apod1a y gpnmb) este efecto apareció después de 12 horas, y en otros (fhl2a, fhl2b y saiyan) solo después de 24 o 48 horas. De ello se deduce que la TH afecta la expresión de genes que se expresan en los iridóforos del pez payaso.
A continuación, los científicos decidieron probar si la TH promueve la diferenciación de iridóforos. Para esto, las larvas de la tercera etapa de desarrollo se trataron con T3 (dosis 10 -6 M) durante mucho tiempo. Esta fue una comparación de los juveniles en la sexta etapa, cuando comienzan a desarrollarse rayas en la cabeza y el cuerpo en los peces payaso.
Curiosamente, los jóvenes del grupo de prueba (tratamiento T3) no formaron completamente bandas, a diferencia del grupo de control. Un examen detallado de los individuos del grupo de prueba reveló numerosos iridóforos ectópicos en los lados. Estos peces también tenían un color naranja menos vibrante.
El procesamiento con MPI dio como resultado rayas normales. Sin embargo, el color fue más apagado debido a la falta de iridóforos o depósitos de guanina cristalina dentro de los iridóforos, generalmente responsables del color blanco (o iridiscente) de las rayas ( 3I ).
Estos resultados sugieren que la TH exógena conduce a una disminución de la coloración naranja y defectos en la formación de rayas blancas.

Imagen No. 4
Sin embargo, el tratamiento con TH aceleró el proceso de rayado. Recuerde que los peces de la especie A. percula que viven en la anémona de mar S. gigantea forman rayas blancas más rápido que sus contrapartes que viven en anémonas de otra especie. Por lo tanto, debe haber alguna conexión entre la formación de franjas, la TH y el hábitat.
Para comprobar esto, los científicos seleccionaron 12 individuos de 12-27 mm de tamaño (una franja blanca se está formando o ya está formada) que viven en S. gigantea (n = 6) y en H. magnifica (n = 6). A continuación, los científicos midieron el nivel de TH de cada individuo.
La comparación mostró que las concentraciones de T3 eran significativamente más altas en animales jóvenes de S. gigantea frente a los de H. magnifica ( 4A ). A continuación, se realizó una comparación de la expresión génica en animales jóvenes de H. magnifica (n = 3) y de S. gigantea (n = 3).
De los 19063 genes analizados, solo 21 se expresaron significativamente más en individuos de S. gigantea , mientras que 15 se expresaron significativamente más en individuos de H. magnifica ( 4B ).
Entre los genes expresados diferencialmente, se encontró el gen duox, que codifica una doble oxidasa involucrada en la producción de TH. Este gen se sobreexpresó en S. gigantea en comparación con H. magnifica . En consecuencia, la tasa de formación de rayas blancas en A. percula se asocia con el nivel diferencial de T3, que, a su vez, se asocia con la expresión diferencial de duox.
En la etapa final, los científicos comprobaron si se requiere duox para formar el patrón iridóforo. Para esta prueba se utilizó pez cebra, en el que la maduración de los iridóforos depende de la TH.
En las larvas del grupo de control, los iridóforos densamente empaquetados formaron una fila intermedia ancha, luego la segunda fila intermedia comenzó a formarse ventralmente. En las larvas deficientes en duox, solo se ha desarrollado una zona intermedia más amplia ( 4C ).
Como resultado, la mayoría de los peces del grupo de control desarrollaron dos filas intermedias completas, mientras que en los peces deficientes en duox solo una ( 4D y 4E ). Esto sugiere que duox, presuntamente actuando a través de TH, contribuye a la sincronización de la aparición de las regiones entre bandas del iridóforo y a la formación del patrón entre las bandas en el pez cebra.
Para un conocimiento más detallado de los matices del estudio, le recomiendo que consulte el informe de los científicos y materiales adicionales .
Epílogo
En este trabajo, los científicos decidieron revelar el secreto de las rayas blancas en el cuerpo del pez payaso. Resultó que este color sin complicaciones (especialmente en comparación con algunos otros peces) es el resultado del trabajo conjunto de varios factores importantes: genes, hormonas e incluso anémonas en las que viven los peces payaso.
La observación más inusual fue que los peces de la misma población, pero que viven en dos especies diferentes de anémonas, forman su color de manera diferente (en términos de tiempo). La comparación de los genes de estos peces mostró que solo difieren 36 genes. Entre ellos, los científicos han aislado el gen duox, que codifica una proteína del mismo nombre, que participa en la formación de la doble oxidasa. Este gen juega un papel importante en la producción de hormonas tiroideas (TH), que a su vez afectan la velocidad a la que se forman los patrones de pigmentación en el cuerpo de los peces payaso.
Pero, ¿por qué los peces de una anémona de mar "colorean" más rápido que otros? Los científicos aún no están preparados para dar una respuesta exacta, pero tienen una teoría. Actinia, en la que las rayas corporales se forman más rápidamente, probablemente sea más tóxica. Por lo tanto, los niveles de hormona tiroidea aumentan en respuesta a esta toxicidad.
Los propios científicos creen que la diferencia en la tasa de formación de franjas en individuos de la misma población es solo uno de los muchos signos de diferentes tácticas de adaptación que utilizan los peces para aumentar la coexistencia efectiva con las anémonas. En el futuro, tienen la intención de realizar un análisis comparativo aún más completo de los peces que viven en diferentes anémonas para identificar diferencias adicionales.
La naturaleza parece simple y sin complicaciones: los árboles crecen, los pájaros cantan, las abejas zumban, etc. Pero después de un examen más detenido, comenzamos a notar cuántos procesos complejos ocurren en la vida incluso del insecto más pequeño o de la planta más extendida. Todas las propiedades, características y cualidades que posee un organismo son el resultado de una larga y minuciosa evolución, cuyo principal objetivo es la supervivencia. Y si un organismo quiere sobrevivir en un mundo en constante cambio, debe utilizar todo el arsenal de talentos adaptativos, desde los más primitivos hasta los más complejos.
Gracias por su atención, ¡tengan curiosidad y tengan un gran fin de semana, chicos! :)
Un poco de publicidad
Gracias por estar con nosotros. ¿Te gustan nuestros artículos? ¿Quieres ver contenido más interesante? Apóyenos haciendo un pedido o recomendando a amigos, un VPS en la nube para desarrolladores desde $ 4.99 , un análogo único de los servidores de nivel de entrada que hemos inventado para usted: Toda la verdad sobre VPS (KVM) E5-2697 v3 (6 núcleos) 10GB DDR4 480GB SSD 1Gbps desde $ 19 o ¿cómo dividir el servidor correctamente? (opciones disponibles con RAID1 y RAID10, hasta 24 núcleos y hasta 40GB DDR4).
¿Dell R730xd es 2 veces más barato en el centro de datos Maincubes Tier IV en Ámsterdam? ¡Solo tenemos 2 x Intel TetraDeca-Core Xeon 2x E5-2697v3 2.6GHz 14C 64GB DDR4 4x960GB SSD 1Gbps 100 TV desde $ 199 en los Países Bajos!Dell R420 - 2x E5-2430 2.2Ghz 6C 128GB DDR3 2x960GB SSD 1Gbps 100TB - ¡Desde $ 99! Lea sobre Cómo construir la infraestructura de bldg. clase con el uso de servidores Dell R730xd E5-2650 v4 a un costo de 9000 euros por un centavo?