
Cada año, la línea entre el hombre y la máquina se hace más delgada. Por supuesto, el nivel de "Deus Ex" todavía está muy lejos, pero ahora hay varios tipos de prótesis, aumento y otros dispositivos que funcionan en estrecha conexión con el sistema nervioso del usuario. Uno de los ejemplos más claros de este futurismo es NCI (interfaz de neurocomputadora), que asegura el intercambio de información entre el cerebro y la computadora. El problema es que para el funcionamiento completo del NCI, se requiere una pequeña actualización por parte del usuario: la implantación de electrodos en el cerebro. Suena mucho más siniestro de lo que realmente es, pero no todo el mundo considera que este método sea el más eficaz. Científicos del Instituto de Tecnología de California (EE. UU.) Han desarrollado un sistema que lee la actividad cerebral mediante un método no invasivo basado en ultrasonidos. Cómo funciona exactamente el dispositivo creado,¿Qué lograron los científicos ver en los cerebros de los sujetos de prueba y qué tan preciso es este desarrollo? Encontraremos respuestas a estas preguntas en el informe de los científicos. Vamos.
Base de investigación
La esencia de la interfaz de la neurocomputadora es bastante simple: leer la actividad neuronal del cerebro humano para comprender sus intenciones. La información obtenida se puede utilizar como señales para controlar dispositivos neuroprotésicos. Hablando exageradamente, con la ayuda del NCI, una persona puede controlar tanto el cursor del mouse (sin el mouse en sí) como una prótesis electrónica con el poder del pensamiento.
Es en el campo de la prótesis donde esta tecnología atrae más atención. Dado que no siempre es posible utilizar prótesis que lean señales de terminaciones nerviosas en el área de contacto o señales de actividad muscular. LCI le permite prescindir de intermediarios periféricos y conectar directamente al usuario (es decir, el cerebro) y el dispositivo.
Las interfaces neuronales más modernas se basan en la electrofisiología intracortical (dentro de la corteza cerebral), que proporciona acceso directo a las señales eléctricas de las neuronas con excelente resolución temporal. El problema de esta técnica es la necesidad de implantar electrodos, que se realiza mediante cirugía cerebral abierta. Es obvio que tales procedimientos tienen consecuencias graves en forma de daño tisular crónico y destrucción del material del implante. Además, los electrodos invasivos son difíciles de escalar y tienen una densidad de muestra limitada y, por lo tanto, no pueden capturar la actividad cerebral completa.
Una solución lógica a este problema es el desarrollo de un método no invasivo para conectar el dispositivo al cerebro. Una de las opciones es la electroencefalografía no invasiva (EEG), que se ha estado desarrollando desde 1973. Sin embargo, el rendimiento del EEG está limitado por la representación topográfica de la actividad de grandes volúmenes cerebrales y la dispersión de la señal de conductancia de volumen a través de varios tejidos y huesos.
En el trabajo que estamos considerando hoy, los científicos proponen una alternativa en forma de NCI basada en imágenes de ultrasonido funcional (fUS de ultrasonido funcional). fUS permite la visualización de cambios regionales en el volumen sanguíneo mediante angiografía Doppler ultrarrápida. Este método proporciona una excelente resolución espacio-temporal (<100 μm y 100 ms) y una alta sensibilidad (velocidad ~ 1 mm / s) con un gran campo de visión (varios centímetros, que es bastante para estos dispositivos).
fUS se desarrolló en 2011. Desde entonces, se ha utilizado con frecuencia para visualizar la actividad neuronal durante los ataques epilépticos, procesar estímulos olfativos y realizar tareas de comportamiento en roedores. También se han realizado experimentos con palomas, hurones y primates. Además, la fUS es 5-10 veces mejor en términos de resolución y sensibilidad espacio-tiempo en comparación con la fMRI (de la resonancia magnética funcional, es decir. resonancia magnética funcional), por lo que puede obtener mucha más información sobre la actividad del cerebro.
En el transcurso del estudio, se llevaron a cabo experimentos con dos monos experimentales: uno fue entrenado para realizar movimientos sacádicos (movimientos oculares agudos) para enfocar un objeto (rastrear figuras en la pantalla), y el segundo fue entrenado para realizar ciertos movimientos desde memoria (controlar una palanca). En experimentos prácticos, los científicos leen la actividad neurovascular sobre la corteza parietal posterior (PPC para la corteza parietal posterior ) a través de una ventana craneal mínimamente invasiva.
¿Por qué exactamente la corteza parietal posterior? Esta área es una zona de asociación ubicada entre las regiones de la corteza visual y motora. Participa activamente en funciones cognitivas de alto nivel, incluida la atención espacial, la integración multisensorial y las transformaciones sensoriomotoras para la planificación del movimiento. El PPC en sí se puede dividir en subáreas funcionalmente específicas: área intraparietal lateral (LIP del área intraparietal lateral ) - planificación del movimiento ocular (cuando vamos a mirar algo); región de captura parietal (PRR de la región de alcance parietal ): planificación del movimiento de la captura de un objeto (cuando vamos a recoger algo).
Los científicos señalan que fUS le permite visualizar simultáneamente ambas subregiones (LIP y PRR), es decir, estarán dentro de un marco (volumen de corte aproximado 12,8 x 13 x 0,4 mm). Además, debido a que PPC codifica aspectos de alto nivel de la planificación del movimiento, es una fuente única de señales de control antes del movimiento real.
Preparación para la investigación
Se instaló un transductor en miniatura (transductor) con una matriz lineal de 128 elementos (15 MHz) por vía epidural (sobre la duramadre) a través de la ventana craneal. Este sensor ha proporcionado imágenes fUS que sirven como base para el análisis de señales neurovasculares en PPC relacionadas con la tarea en cuestión. El transductor proporcionó una resolución espacial de 100 x 100 µm en el plano, un grosor de corte de ~ 400 µm, cubriendo un plano con un ancho de 12,8 mm y una profundidad de penetración de 16 mm.
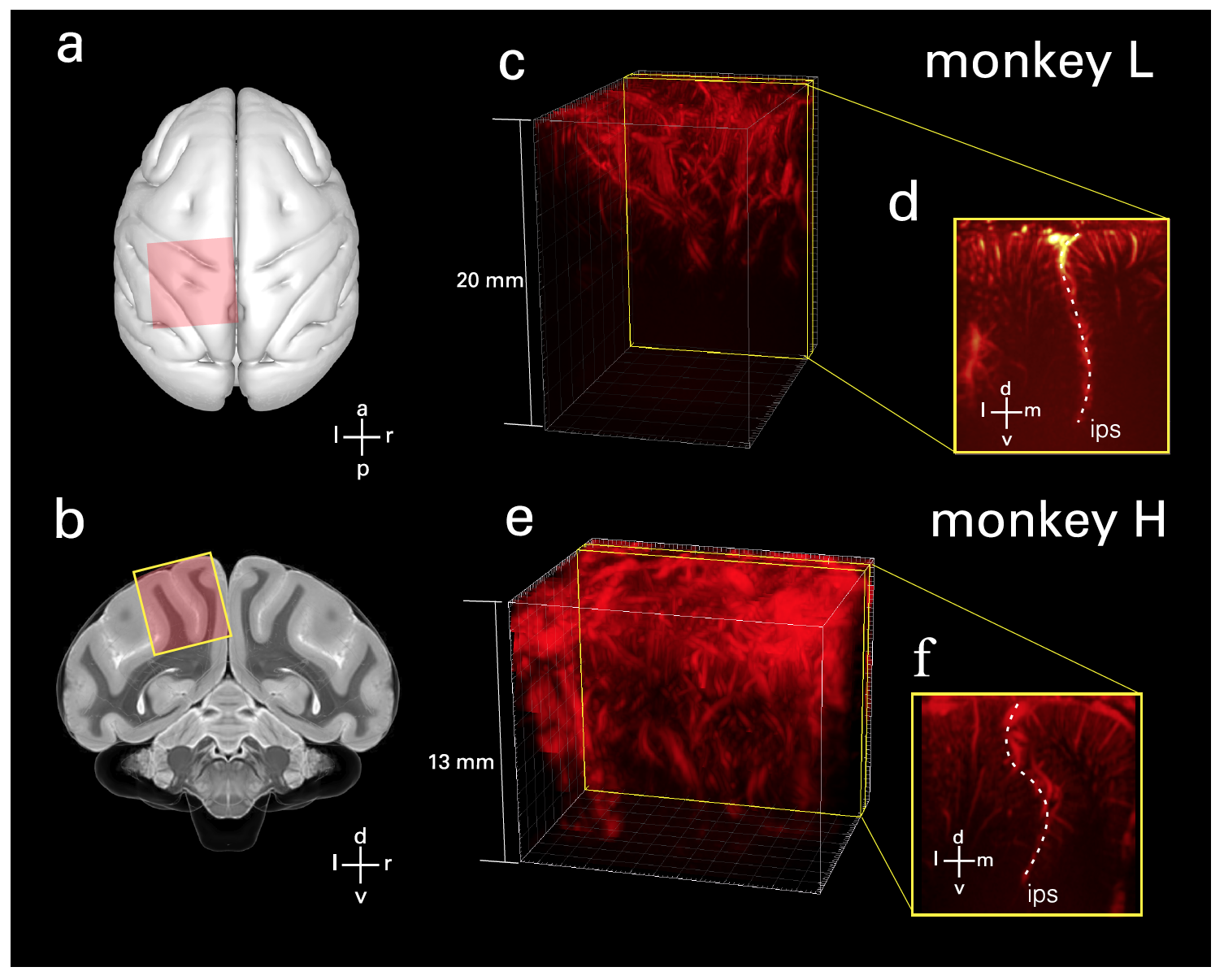
Imagen # 1 La
sonda se colocó perpendicular a la superficie en una orientación coronal sobre la duramadre sobre el PPC ( 1a y 1b ). Además, de los volúmenes disponibles, se seleccionaron los planos de interés ( 1c- 1f ).
Específicamente, se seleccionaron planos que mostraban actividad hemodinámica (movimiento sanguíneo) ajustada al comportamiento y capturaban los lados lateral y medial del surco intraparietal (IPS del surco intraparietal ; coordinación sensorial-motora) en una sola imagen. Esto hizo posible evaluar las funciones de varias áreas del cerebro simultáneamente. Y la geometría de la imagen de ultrasonido permitió el acceso a las áreas corticales en los surcos.
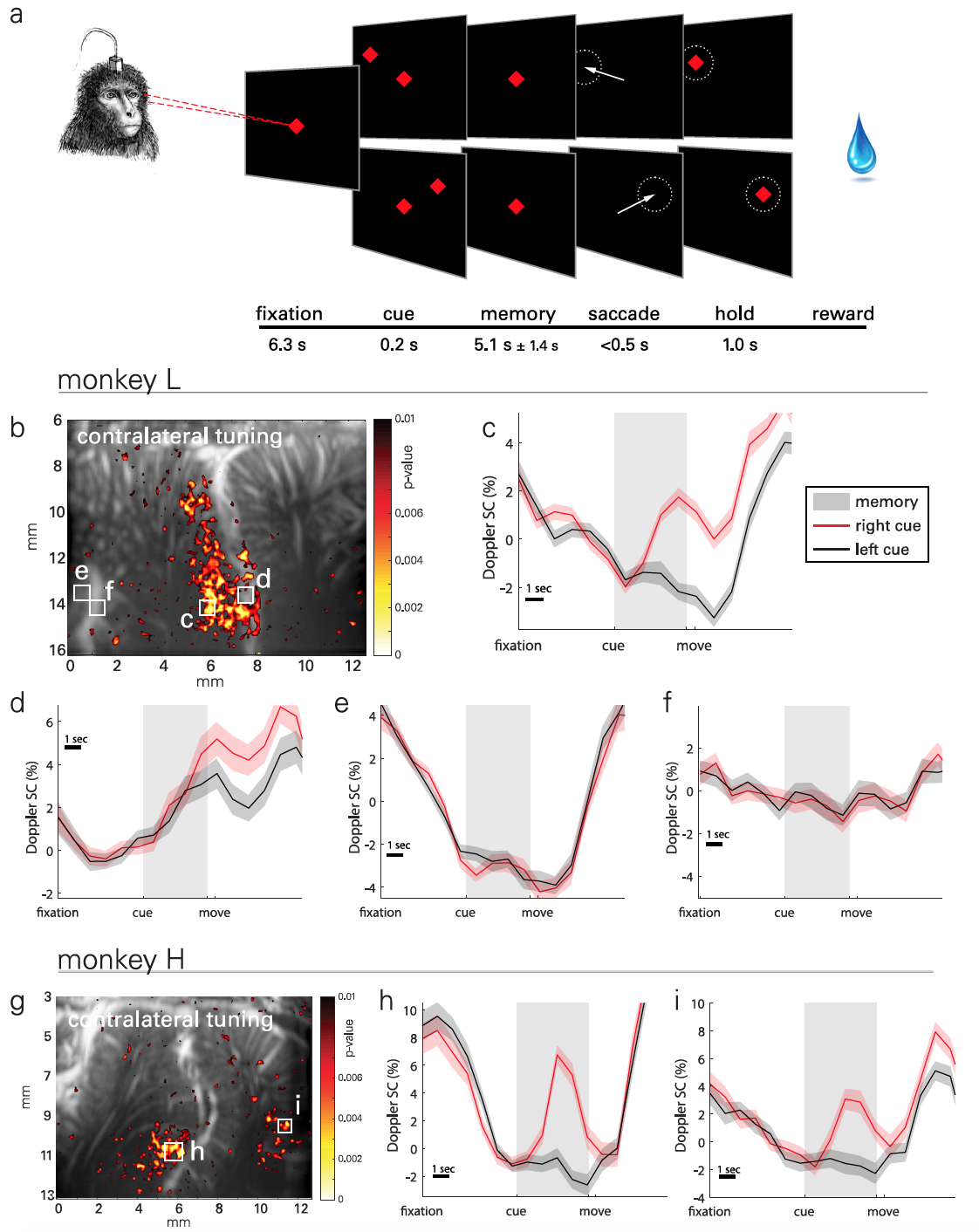
Imagen No. 2
La esencia de los experimentos prácticos era que los monos tenían que memorizar la ubicación del objeto ubicado en el lado izquierdo o derecho de la pantalla y realizar el movimiento después de que el objeto en el centro de la pantalla se apagaba ( 2a ). La fase de memorización fue lo suficientemente larga (5,1 ± 1,4 s) para registrar la hemodinámica transitoria. En total, se recopilaron datos de 30 pruebas realizadas durante 18 días. Se realizaron hasta 5 carreras cada día, cada una de las cuales incluía metas de 30 minutos generadas al azar para una tarea.
Para visualizar los patrones espacio-temporales de actividad lateralizada en PPC ( 2b ), se utilizaron mapas paramétricos estadísticos basados en la prueba t de Student ( ejemplo de cálculo de la prueba t de Student ).
El resultado observado asociado con tareas medias (ERA del promedio relacionado con el evento ) cambios en el volumen sanguíneo cerebral (VBC del volumen sanguíneo cerebral ) de las regiones localizadas de tamaño 100 x 100 mm ( 2c - 2f ). La foto 2g muestra un mapa típico de la actividad del segundo sujeto y 2h - 2i de su ERA.
Se observaron señales de actividad neurovascular en el lado lateral del IPS, es decir, en el LIP, para ambos animales. Sin embargo, las formas de onda de ERA fueron similares entre sujetos en esta área.
Los fUS de alta sensibilidad y resolución espacio-temporal permiten distinguir funciones entre regiones adyacentes en una escala de cientos de micrones, por ejemplo, dentro de subregiones de PPC como LIP.
Por ejemplo, la segunda región LIP ( 2d ) también muestra sintonía contralateral, pero la diferencia en la actividad surge más tarde en el período de memorización y persiste durante el movimiento y entre experimentos.
Un sujeto (mono H) mostró una respuesta direccional similar en la región parietal medial (MP de parietal medial ) en la pared medial del hemisferio. Pero en el mono L, no se encontró tal efecto, ya que en su caso la ubicación de la sonda se optimizó para la región LIP, y no para el MP, que en este caso estaba fuera de la pantalla. Sin embargo, esta configuración confirma aún más el papel de MP en el movimiento ocular direccional.
Proceso de decodificación de señales
Antes de considerar los resultados de los experimentos prácticos, se recuerda a los científicos que la principal tarea de NKI es predecir la próxima acción prevista utilizando señales cerebrales. Para comprender si la visualización fUS ayuda a lograr esta tarea, la predicción de la dirección del próximo movimiento ocular del sujeto se llevó a cabo sobre la base de una ejecución de prueba.
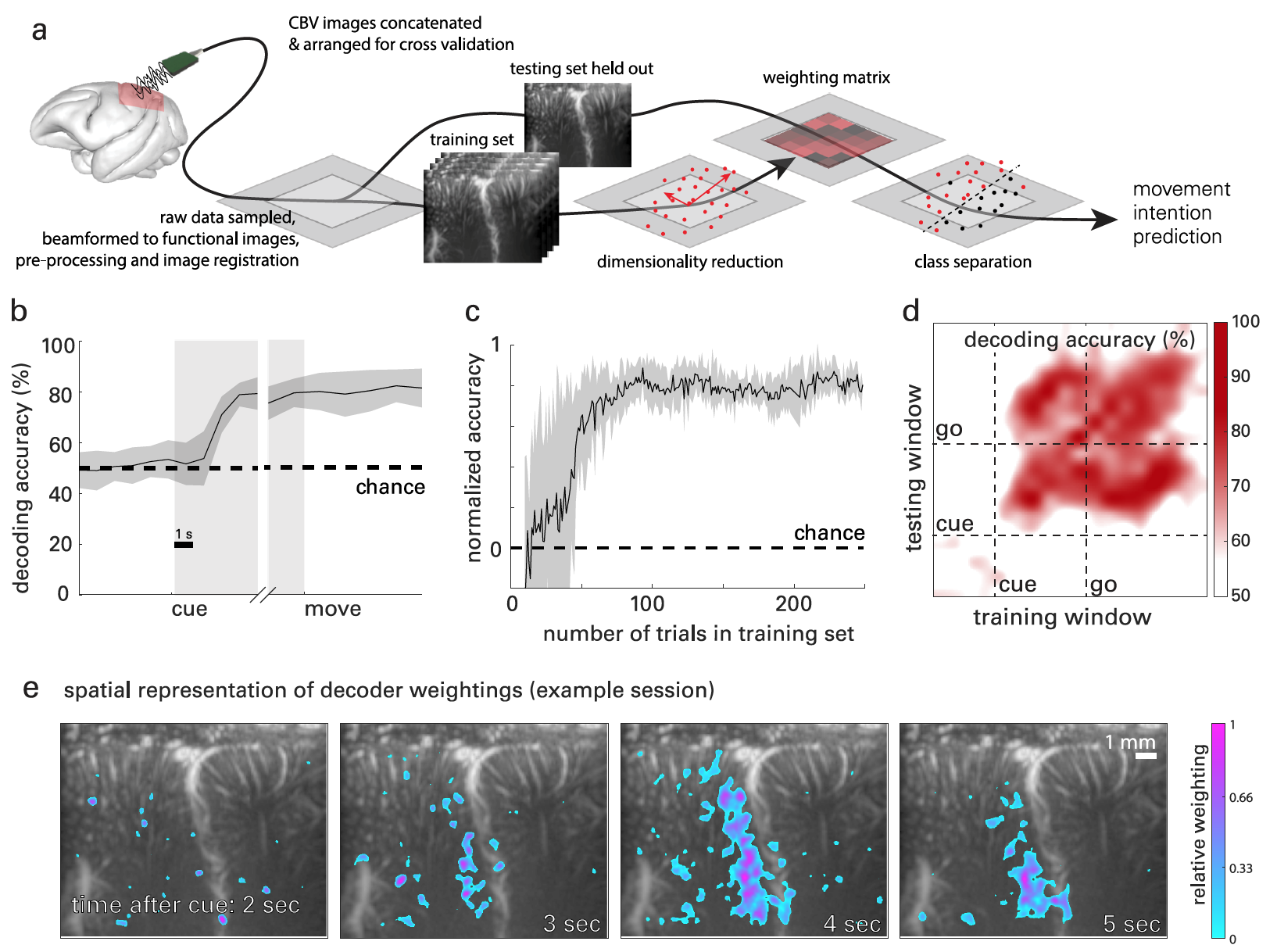
Imagen # 3 La
Figura 3a muestra una interpretación gráfica del proceso de decodificación de señales cerebrales basada en datos de fUS. Se utilizó el análisis de componentes principales según la clase (CPCA ) para reducir la dimensionalidad * datos, pero conservando suficientes componentes para obtener> 95% de la varianza en los datos.
La reducción de dimensión * es un proceso de transformación de datos cuando se reduce el número de variables obteniendo las variables principales.A continuación, se utilizó la regresión de mínimos cuadrados ordinarios (OLSR ) para hacer una regresión de los datos transformados por PCA antes de la ejecución real del movimiento.
Para analizar la evolución temporal de las señales PPC asociadas a la ejecución de una tarea, se descifró la dirección del movimiento en el tiempo a través de las etapas de cada abordaje experimental: fijación (mirada al objeto central), memorización y movimiento.
Para cada punto de tiempo, se utilizaron todos los datos previos tanto de entrenamiento como de prueba. Por ejemplo, en t = 2 s, era necesario incluir todos los datos en los conjuntos de datos de entrenamiento y prueba en t = de 0 a 2 s.
Las curvas resultantes ( 3b ) muestran la precisión en el nivel de aleatoriedad durante la fase de fijación, cambios menores durante la fase de almacenamiento y precisión de decodificación estable durante la fase de movimiento.
Durante la fase de memorización, la precisión del decodificador alcanzó 2,08 s ± 0,82 s después de que el sujeto recibió la señal de dirección, pero antes del movimiento real. En el futuro, la precisión del decodificador solo aumentó.
El reanálisis eliminó todos los datos del conjunto de entrenamiento. Esto hizo posible determinar la cantidad de datos necesarios para lograr la máxima precisión de decodificación ( 3c). Después de 27 ejecuciones de prueba, la precisión del decodificador llegó a ser tal que se necesitaron datos de solo 10 ejecuciones de entrenamiento para la predicción y clasificación de movimiento posteriores. El nivel máximo de precisión del decodificador se logró después de 75 ejecuciones de prueba.
En otras palabras, los científicos pudieron minimizar la cantidad de datos necesarios para reconocer con precisión las señales cerebrales, mientras que el nivel de precisión de este proceso se mantuvo bastante alto.
Además, se realizó un análisis para determinar qué tipo de información está contenida en las señales cerebrales utilizadas por el decodificador. Para ello, se utilizó el método de decodificación dinámica, que requiere datos durante un período de 1 segundo para entrenar el decodificador. Además, la dirección asumida se descodificó a partir de las ventanas de datos con una duración de 1 s durante toda la ejecución de la prueba. Es decir, el decodificador tenía que entender qué iba a hacer el mono analizando los datos de un período de solo 1 segundo.
Como resultado, se obtuvo una matriz de nxn valores de precisión, donde n es el número de ventanas de tiempo comprobadas. 3d muestra la precisión de cada combinación de aprendizaje / decodificación.
Resultados de la prueba
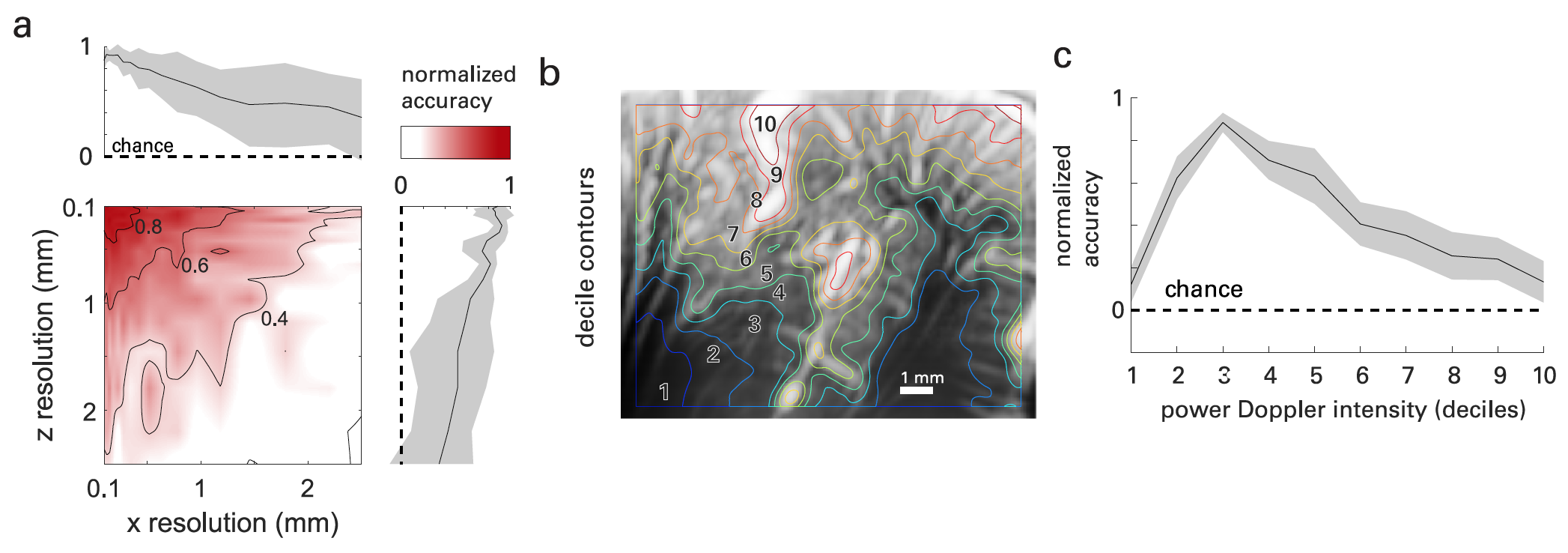
La imagen n. ° 4
fUS proporciona una alta resolución y sensibilidad espacio-temporal, en contraste con el método fMRI. Esto proporciona datos sobre la dinámica neurovascular en una escala previamente inaccesible.
Fue bastante fácil comprobar esto. Si cambiamos las dimensiones (en x, es decir, a lo largo de la superficie de la sonda y en z, es decir, en la profundidad de la imagen) de las imágenes obtenidas durante los experimentos, la precisión de decodificación disminuirá con el aumento de el tamaño de los vóxeles ( 4a ).
Estudios recientes han demostrado que la hiperemia funcional comienza en una región vascular llamada unidad primaria. Esta sección incluye arteriolas parenquimatosas (pequeñas arterias delante de los capilares) y capilares, es decir, vasos con un diámetro <50 μm. Por tanto, la velocidad del flujo sanguíneo aumenta en los capilares inferiores y arteriolas superiores.
Teniendo esto en cuenta, los científicos decidieron que la mayor parte de la información funcional utilizada para la decodificación se encontraría en vasos con subresolución (<100 μm) en el plano de la imagen. Para probar esta hipótesis, los mapas de fUS vascular del cerebro se segmentaron (espacialmente) ordenando los vóxeles de acuerdo con su intensidad Doppler media y segmentándolos por deciles * ( 4b ).
El decil * caracteriza la distribución de los valores de la población, en la que nueve valores de decil la dividen en diez partes iguales. Cualquiera de estas diez partes es 1/10 del total.Mientras que los deciles 1-2 involucran principalmente las regiones subcorticales, los deciles 3-8 involucran las capas corticales, donde las capas más superficiales muestran una intensidad promedio más alta. Los deciles 9 y 10 se limitaron principalmente a la vasculatura de las unidades primarias (arterias grandes, generalmente en la superficie cortical y en los surcos). En 4c se muestra la precisión resultante de la decodificación según la intensidad de potencia Doppler.
El análisis de los datos mostró que la actividad neurovascular durante una tarea, medida por fUS, existe principalmente en la anatomía de los vasos ubicados en la corteza cerebral. Es decir, la mayor contribución a las señales fUS corticales se realizó mediante velocidades de flujo axial en el rango de 2 a 10 mm / s, que corresponde a vasos con un diámetro <50 μm, es decir. a saber, arteriolas y capilares.
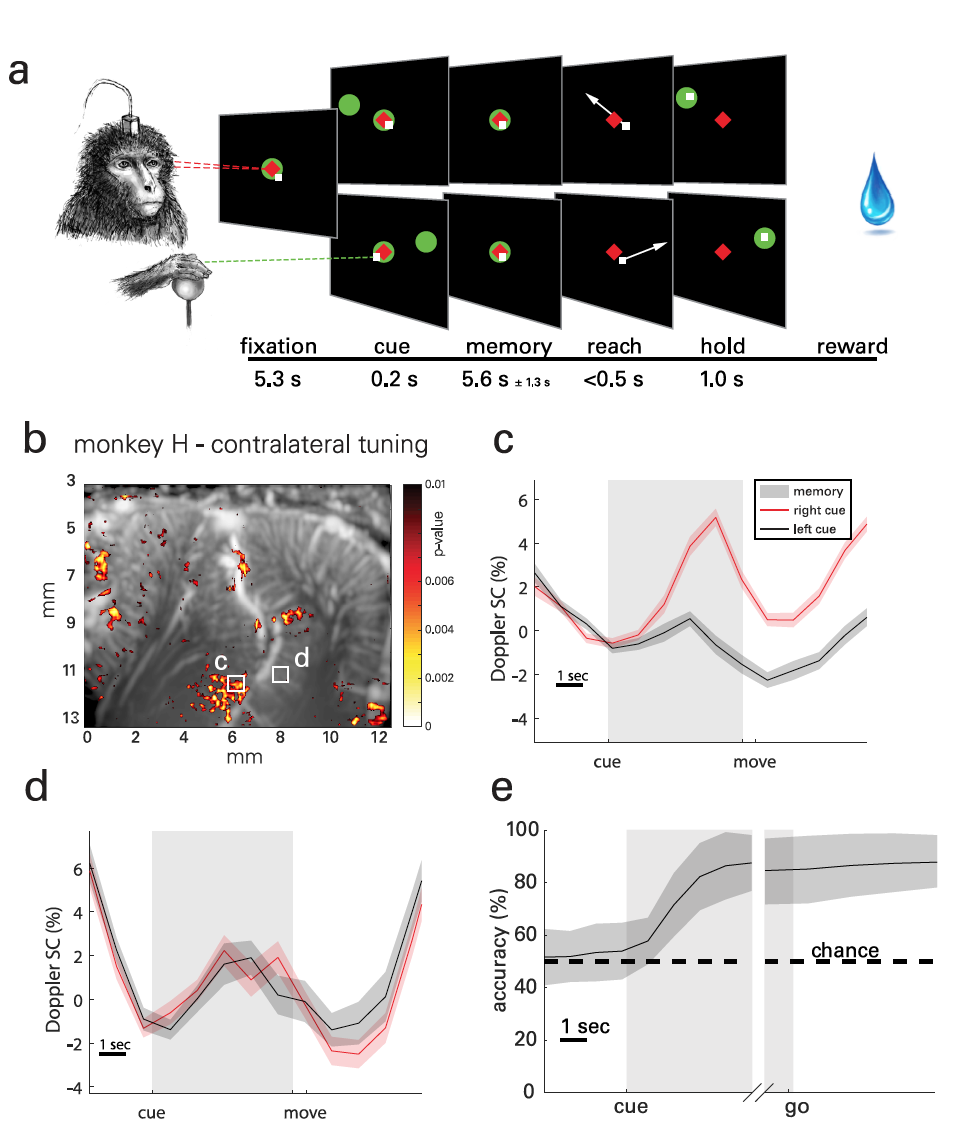
Imagen # 5 Finalmente
, se realizó otra prueba en la que el sujeto tenía que accionar una palanca mientras miraba objetos en la pantalla ( 5a ). Esta tarea fue en muchos aspectos similar a la tarea sacádica, pero la mirada del animal permaneció fija durante toda la prueba, incluso durante las fases de fijación, memorización y ejecución del movimiento.
Los ERA (cambios medios relacionados con la tarea) en el lado lateral del surco intraparietal en el LIP putativo (región intraparietal) identifican poblaciones relevantes para predecir la dirección del movimiento ( 5b - 5c ). Las poblaciones en el lado medial en el área de retención parietal putativa (PRR) no exhiben estas características, pero exhiben una sintonía bilateral con el movimiento real ( 5d ).
Estos resultados son consistentes con registros electrofisiológicos en los que las neuronas PRR como población codifican ambos hemisferios, mientras que las neuronas LIP codifican principalmente el espacio contralateral.
La precisión de la decodificación y su evolución temporal fueron similares a las observadas en experimentos con sacadas ( 5e ). Específicamente, la precisión de decodificación de objetivos con validación cruzada osciló entre el 72,96% y el 94,64% durante una prueba de 30 minutos. La precisión media de todas las sesiones experimentales fue del 88,54%.
Para un conocimiento más detallado de los matices del estudio, le recomiendo que consulte el informe de los científicos .
Epílogo
Las interfaces de neurocomputadoras, a pesar del concepto futurista, son cada año más reales. Su funcionalidad, características y capacidades se amplían, al igual que la gama de posibles aplicaciones. Sin embargo, como ocurre con cualquier tecnología relativamente nueva, los problemas no se pueden evitar.
Uno de los principales problemas en la implementación de un NKI completo es la necesidad de una conexión invasiva. Pocas personas quieren cambiar de canal, por ejemplo, si es necesario abrir el cráneo e insertar un par de electrones en el cerebro. Y ni siquiera se trata de los inconvenientes de un "accesorio" de este tipo, sino de los peligros que conlleva. El método invasivo de conectar el NKI conduce a violaciones sistemáticas de la estructura del tejido y la destrucción del material del dispositivo en sí.
La solución a este problema son las imágenes de ultrasonido funcional (fUS), que le permiten rastrear la actividad cerebral en estas áreas con una precisión increíble con una resolución de hasta 100 micrones. Y esto es realmente impresionante, considerando que el tamaño de una neurona es de aproximadamente 10 micrones.
Los autores de esta técnica afirman que su creación es mucho más productiva que otros métodos. Los electrodos implantados pueden medir con mucha precisión la actividad del cerebro a nivel de neuronas individuales, pero requieren un contacto directo con el cerebro. fMRI (resonancia magnética funcional) no requiere implantación y puede mostrar la actividad de todo el cerebro a la vez, pero el equipo para este método ocupa toda una habitación. La electroencefalografía tampoco requiere la introducción de electrodos, pero su resolución espacial es extremadamente baja. Pero el método fUS, según los científicos, carece de las desventajas anteriores.
El principio de FUS se basa en el flujo sanguíneo en el cerebro. Cuando aumenta la actividad en un área del cerebro, aumenta el flujo sanguíneo hacia ella. fUS permite que esto sea monitoreado al proporcionar una dinámica de alta resolución del flujo sanguíneo cerebral en el espacio y el tiempo. El análisis de los datos del flujo sanguíneo le permite averiguar qué áreas están activas en un momento determinado.
La precisión de FUS en esta etapa de desarrollo es muy cercana al método con electrodos implantados. Pero a diferencia de este último, FUS no necesita una implantación completa. Para trabajar con electrodos, es necesario abrir la duramadre ubicada debajo del cráneo e insertar los electrodos directamente en el cerebro. En el caso de fUS, una pequeña ventana capaz de transmitir ultrasonidos es suficiente. Por el momento, esta ventana se realiza abriendo el cráneo, pero sin ninguna intervención en el propio cerebro. Esta opción es significativamente menos invasiva y, por lo tanto, menos peligrosa.
En el futuro, los científicos tienen la intención de continuar mejorando el FUS para lograr una precisión aún mayor, así como realizar experimentos en personas que, debido a lesiones cerebrales, se sometieron a trepanación de parte de los huesos del cráneo.
¡Gracias por su atención, tengan curiosidad y tengan un gran fin de semana, chicos! :)
Un poco de publicidad
Gracias por estar con nosotros. ¿Te gustan nuestros artículos? ¿Quieres ver contenido más interesante? Apóyenos haciendo un pedido o recomendando a amigos, VPS en la nube para desarrolladores desde $ 4.99 , un análogo único de los servidores de nivel de entrada que hemos inventado para usted: Toda la verdad sobre VPS (KVM) E5-2697 v3 (6 núcleos) 10GB DDR4 480GB SSD 1Gbps desde $ 19 o ¿cómo dividir el servidor correctamente? (opciones disponibles con RAID1 y RAID10, hasta 24 núcleos y hasta 40GB DDR4).
¿Dell R730xd es 2 veces más barato en el centro de datos Maincubes Tier IV en Ámsterdam? ¡Solo tenemos 2 x Intel TetraDeca-Core Xeon 2x E5-2697v3 2.6GHz 14C 64GB DDR4 4x960GB SSD 1Gbps 100 TV desde $ 199 en los Países Bajos!Dell R420 - 2x E5-2430 2.2Ghz 6C 128GB DDR3 2x960GB SSD 1Gbps 100TB - ¡Desde $ 99! Lea sobre Cómo construir la infraestructura de bldg. clase con el uso de servidores Dell R730xd E5-2650 v4 a un costo de 9000 euros por un centavo?