Estructura cristalina de S. aureus Cas9 en un complejo con crRNA y su ADN diana
En publicaciones anteriores, solicitó contar con más detalle sobre CRISPR / Cas9 y los enfoques para la edición del genoma. Simplemente no incluí un material tan voluminoso en la última publicación. Y en esto no incluiré, por ejemplo, el método TALEN, que potencialmente puede ser más preciso y tiene sus ventajas. Pero cariño, sí.
Intentemos recorrer el método de modificación genética ya bien descrito utilizando CRISPR-Cas9 y veamos un poco más ampliamente las perspectivas que nos abre. Estaba enormemente interesado en la dirección del trasplante xenogénico de cerdos a humanos. El primero, los métodos de "precorrección" mostraron que el cuerpo en el interior mata un trasplante de cerdo unos minutos . Pero el método no se descartó en absoluto. Aún así, esta es una forma prometedora de no esperar hasta que muera otro posible donante de órganos, sino de hacerlos crecer con anticipación. Luego resultó que los cerdos también portan un paquete de retrovirus específicos que están integrados en su genoma y pueden causar una epidemia de una nueva xenozoonosis. Y los virus también deben detectarse de alguna manera antes del trasplante. Y en algún lugar aquí aparece gente con bata blanca en el escenario, haciendo algo incomprensible en sus laboratorios ...
El antivirus bacteriano que puso todo patas arriba
En 1987, CRISPR fue descubierto por científicos japoneses dirigidos por Yoshizumi Ishino. En ese momento, llamaron la atención sobre las repeticiones inusuales en el genoma de E. coli, pero no le dieron una importancia particular a esto. Y solo cuando se encontraron repeticiones similares en arqueas, que están genéticamente muy lejos de E. coli, comenzaron a buscar estructuras similares en otros procariotas. Estos fragmentos se denominan CRISPR: repeticiones palindrómicas cortas agrupadas regularmente interespaciadas. Un poco más tarde, también se descubrieron proteínas especiales asociadas a CRISPR, Cas ( CRISPR como proteína asociada). Bien descubierto y descubierto, al parecer. Pero fueron el comienzo de una nueva revolución biotecnológica.
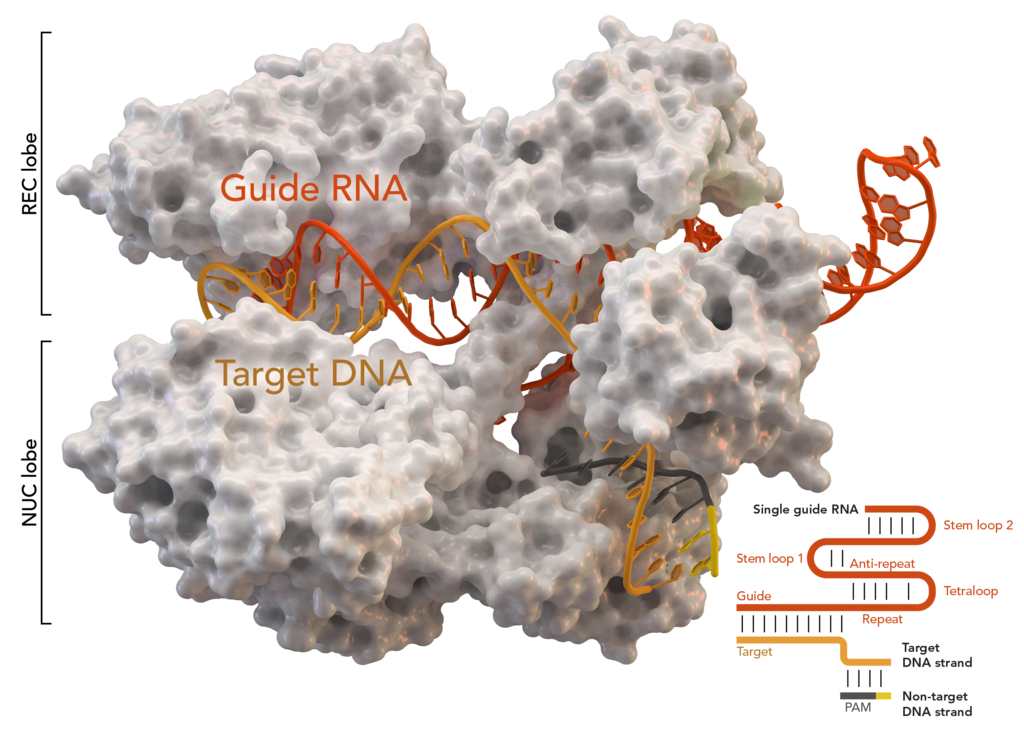
Ahora intentaré decirles cómo funciona y por qué las bacterias lo necesitan. A las bacterias les encantaría sobrevivir. Pero les gusta parasitar virus. Cuando alguien te come, es desagradable y tienes que hacer algo. Como resultado, la respuesta fue un mecanismo complejo pero extremadamente interesante. La bacteria almacena temblorosamente en una parte de su genoma las firmas de todos los villanos que intentan infectarla. Estas son las mismas regiones palindrómicas repetidas: CRISPR. Trabajan junto con proteínas del grupo Cas. Estamos interesados en la clave Cas9. ¿Cómo se ve en vivo, si se simplifica un poco?
Si este sistema no funciona, entonces la célula bacteriana es incapaz de distinguir el genoma viral, cuidadosamente introducido por el bacteriófago, del propio. Y el poco inteligente sistema de síntesis de proteínas se reorienta inmediatamente hacia la liberación de nuevas generaciones de fagos. La celda muere.
Si se activa CRISPR / Cas9, entonces el proceso es diferente. La bacteria usa los datos registrados en CRISPR para crear ARN de control. El complejo de proteínas comienza a desenrollar el ADN para analizarlo antes del "lanzamiento". En caso de que la secuencia coincida con las firmas virales registradas en CRISPR, Cas9 da la alarma e inmediatamente corta el fragmento enemigo reconocido. Es decir, incluso si un virus está incrustado en el genoma bacteriano a nivel de "firmware", se eliminará de allí tan pronto como el antivirus integrado lo reconozca.
premio Nobel
Emmanuelle Charpentier y Jennifer Doudna recibieron el Premio Nobel de Química 2020 por la creación de nuevas tecnologías que permiten a CRISPR-Cas9 realizar la edición del genoma. Esta tecnología hizo posible reemplazar los métodos más precisos en ese momento, pero más complejos y costosos, de dedos de zinc y nucleasas TALEN. Los métodos anteriores requerían el desarrollo, expresión y validación de un par de polipéptidos completamente nuevo para cada nuevo locus objetivo. Y CRISPR-Cas9 dio una herramienta estándar, cuando se usa en la versión mínima, es suficiente para obtener la secuencia de control necesaria, según la cual Cas9 encontrará el área necesaria para la disección.
Bien, hemos cortado el ADN de un ser humano, una levadura o una rata de prueba. Esto es genial, pero ahora tenemos dos piezas rotas y una cadena destruida. Hay varias opciones para coser la espalda.

Puede intentar hacer coincidir las piezas cortadas utilizando el método de unión de extremos no homólogo. El esta a la derecha. En pocas palabras, en esta versión simplemente estamos tratando de acoplar la rotura doble directamente y soldarla en un solo todo. Este mecanismo es bastante ineficaz, en el proceso de "ajuste" las partes de los extremos individuales pueden caerse. Como resultado, a menudo se pierden pequeños fragmentos en la zona de rotura o, por el contrario, aparecen inserciones cortas. Este enfoque generalmente desactiva el gen de manera irreversible, dejándolo defectuoso.
La segunda opción es más interesante. Está en la ilustración de la derecha. La reparación por recombinación homóloga implica la sustitución de una secuencia eliminada por una nueva secuencia complementaria a una plantilla de reparación creada por el propio investigador. Como resultado, es posible no solo apagar el gen de alguna manera, sino reemplazar la secuencia mutante con la normal.
El principal problema del método es que es probabilístico. Sí, en un gran porcentaje de casos, funcionará exactamente como debería. Pero en muchas células, o no dará el efecto deseado o romperá algo. Y es bueno que solo las células individuales mueran a causa de esto y no se conviertan, por ejemplo, en células tumorales. Por lo tanto, todos estos cambios deben probarse a fondo. Afortunadamente, enfoques relativamente nuevos Mejorar la especificidad mediante la creación de un Cas9 personalizado puede reducir el número de cortes erróneos a casi cero.
Xenoinjertos
Como dije antes, el uso masivo de estas técnicas frena la especificidad. Si nuestra maravillosa molécula simplemente pierde el 20% de las células, no es gran cosa. Esto significará que el 80% de las células humanas con una mutación congénita están fijas y ya comenzarán a producir la enzima correcta, a dividirse adecuadamente oa hacer otra cosa correctamente. Como regla general, esto es más que suficiente para que una persona se vuelva clínicamente saludable.
En esta sección, me gustaría hablar un poco sobre cómo la edición del genoma puede resolver potencialmente el problema de la donación de órganos. Debo decir que la falta de órganos para trasplante se ve muy triste. Tiempos de espera enormes y muchas cuestiones éticas.
El número de trasplantes de órganos realizados en Rusia es cientos de veces menor.necesidades. Si el mismo riñón se puede trasplantar de un pariente adecuado, entonces ya se garantiza que un trasplante de corazón significará la muerte del donante. Una de las áreas clave en la búsqueda de una fuente ilimitada de órganos es el xenotrasplante. Esta es una opción para trasplantar tejidos y órganos entre diferentes especies. Uno de los donantes más adecuados en estructura y tamaño para los seres humanos es un cerdo , por extraño que parezca. Los primates, aunque genéticamente más cercanos, son generalmente de tamaño mucho más pequeño y muy costosos de criar. Desafortunadamente, los primeros experimentos con trasplantes de órganos porcinos mostraron que comienzan a rechazar con una respuesta hiperaguda a los pocos minutos de conectarse al torrente sanguíneo.
Cómo modificar un cerdo

Para que el trasplante no sea rechazado, es necesario al menos eliminar los genes diana responsables de la síntesis de las proteínas más extrañas para nosotros. La primera de estas proteínas es la enzima alfa-1,3-galactosa, que en todos los primates se rompe de forma irreversible en el curso de la evolución. Es él quien provoca la aparición del rechazo a los pocos minutos . La corrección genética permitió crear una raza de cerdos.con un gen desactivado responsable de la síntesis de la enzima: cerdo GTKO. Aunque esto ralentizó significativamente el proceso de rechazo, no lo detuvo por completo. Resultó que el ácido N-glicolilneuramínico y la β1,4 N-acetilgalactosaminiltransferasa, que están ausentes en los primates, también son problemáticos. Estos genes también se eliminaron y los cerdos GGTA1 / CMAH / β4GALNT2 KO se obtuvieron con los tres genes desactivados a la vez. Es de suponer que esto prácticamente puede neutralizar la reacción de rechazo . En teoría, si resulta que también obliga a las células de cerdo a sintetizar la glicoproteína de superficie CD47 de una persona, entonces la compatibilidad será bastante excelente .
Hubo una publicación muy prometedora en 2018 sobre el trasplante de corazón de cerdos transgénicos a babuinos. De los 5 babuinos, solo uno tuvo problemas, el edema pulmonar comenzó por razones quirúrgicas y tuvo que ser retirado del experimento antes de tiempo. El resto sobrevivió hasta el final de su período de experimento con buena salud. De dos a tres meses y de dos a seis meses. Hubo algunos problemas debido al crecimiento del órgano, ya que el corazón de un cerdo es más grande que el de un babuino, pero para una persona esto no será un problema.
¿Tenemos un nuevo VIH por delante?

Árbol filogenético del VIH y virus relacionados en chimpancés
Parecería que nos espera un futuro brillante, donde una manada separada de cerdos especiales de laboratorio pastará para la producción de órganos de donantes. Pero aquí también surgen muchos problemas éticos. Sospecho que tal método será inaceptable para los representantes de varias religiones, lo que automáticamente lo hace inaccesible para una gran proporción de la población mundial.
Los cerdos también tienen retrovirus. Estos incluyen, por ejemplo, un lentivirus tan maravilloso como el virus de la inmunodeficiencia humana y los virus de primates relacionados. Se cree que fue el virus de los primates el que dio lugar a la masiva epidemia del VIH en los años 70 del siglo pasado. Y ahora una persona no sabe qué hacer con él. Los cerdos son portadores de PERV, retrovirus endógenos porcinos. Y no puede deshacerse de estos virus mediante la reproducción cuidadosa y las medidas anti-epidémicas, ya que los virus ya están firmemente incrustados en el genoma de sus células. La investigación se llevó a cabo que debería dar una posible solución. Para empezar, tomaron células de cerdo y las cultivaron en el mismo cultivo que las células embrionarias de un riñón humano. Lo más molesto es que pudieron identificar células humanas infectadas con retrovirus porcinos, lo que potencialmente indica tal posibilidad de trasplante. Como solución, propusieron el preprocesamiento de células con CRISPR-Cas9 y la escisión completa de todos los fragmentos virales del cultivo de células del epitelio renal porcino.
Biotecnología y riesgos
Es difícil predecir a dónde conducirá todo esto. Desafortunadamente, los riesgos de contraer un mutante viral exótico de un trasplante de este tipo están lejos de ser cero. Y existe la posibilidad de que dicha infección también se propague de manera silenciosa e imperceptible, antes de que se vuelva obvia, como sucedió en su época con el VIH. Y, sin embargo, soy bastante optimista. Inevitablemente, pisaremos mucho en el proceso de investigación, pero ahora tenemos las herramientas para tratar enfermedades que antes eran mortales y prolongar la vida humana.
