
Me pregunto cómo terminará nuestra investigación
Parece que el tema anterior sobre el salmón transgénico ha sido bastante bien recibido para los Habrachiters. Mientras preparamos material sobre modificación de plantas, sugiero que analicemos un tema igualmente interesante: la modificación genética del Homo Sapiens. Este es un tema muy controvertido y holivar, que es inútil ignorar.
Enseguida daré varias tesis que pueden parecer controvertidas, pero que de alguna manera necesitan ser resueltas en la comunidad científica:
- Nos estamos degenerando. Cada año, las personas más débiles sobreviven, dan a luz a sus hijos y cargan el acervo genético. Necesita ser arreglado.
- Las prohibiciones simples no ayudarán. Si los experimentos están prohibidos en Europa, entonces, por ejemplo, China los realizará.
- No nos detendremos en el tratamiento de enfermedades genéticas. Tarde o temprano, los militares se unirán a sus súper soldados y a aquellos que quieren niños más fuertes e inteligentes con ojos azules.
Intentaré dar un repaso a las técnicas de intervención existentes en el genotipo de personas y al mismo tiempo analizaremos con qué nos amenaza.
Que es la terapia génica
Primero definamos la terminología. La terapia genética es una intervención en el genoma humano con el objetivo de tratar determinadas enfermedades. Además, la intervención es solo en células somáticas. Estas son las células que no se reproducen. Claramente, no necesitamos corregir ninguna mutación ni corrección de errores en las nuevas generaciones. Por ahora al menos.
Los experimentos con animales reales comenzaron alrededor de la década de 1980, pero luego solo fueron pasos tímidos. No teníamos ningún tipo de belleza como las impresoras de ADN, que expresan vectores para eucariotas.
¿Dónde podemos realmente intervenir?
Plásmidos
Para empezar, puede dejar el núcleo celular, que contiene la información genética básica. Puedes usar plásmidos.

1) ADN cromosómico de bacterias 2) Plásmidos
Los plásmidos son casi exclusivamente bacterianos. A veces se encuentra en hongos primitivos y en algunas plantas. De hecho, esto es ADN, pero doblado en un anillo y flotando por separado en el citoplasma. Es decir, un mecanismo tan separado para almacenar material genético. Para las bacterias, son muy importantes para transmitir mutaciones positivas, por ejemplo, para "informar a los vecinos" sobre las opciones de protección antibiótica. El truco de los plásmidos cuando se usan en humanos es que se deshacen por sí solos después de algún tiempo después de ser introducidos en la célula. Y tampoco afectan el principal aparato genético de la célula. Es decir, el firmware principal no se verá afectado.
Parcheo del kernel
A continuación, tenemos la capacidad de editar directamente el fragmento de código en el kernel. Este es un procedimiento más invasivo y ya conlleva el riesgo de insertar o cortar incorrectamente un fragmento de ADN. Pero esta es prácticamente la única opción para arreglar radicalmente algún defecto genético grave, ya que las células somáticas se dividirán y transmitirán la versión parcheada del ADN a sus descendientes.
Mitocondrias
Las mitocondrias son como reactores nucleares en una célula. Consumen ácidos grasos y glucosa y, a la salida, sellan macroergos, sustancias con alta energía de unión. Por ejemplo, ATP. Es un "combustible" universal para todas las reacciones activas, por ejemplo, para el funcionamiento de bombas de membrana osmótica contra un gradiente de concentración.
Tienen una peculiaridad: su propio aparato genético. En realidad, parecen simbiontes semiautónomos por esta misma razón. Su aparato genético tiene sentido para gobernar con mutaciones congénitas en el ADN mitocondrial. Por lo general, estos también son síndromes congénitos muy graves.
El vector viral es como una jeringa
El primer punto clave es el desarrollo de herramientas de distribución: vectores virales. El primer virus de este tipo para mamíferos se desarrolló en 1984. Se utilizó un retrovirus murino como jeringa molecular. Él en sí mismo era una herramienta muy desagradable, ya que con una alta probabilidad provocaba enfermedades oncológicas. En realidad, su segundo nombre es virus de la leucemia murina (MLV). En el futuro, el desarrollo cambió a opciones más seguras.
¿Qué es exactamente un vector viral? Este es un virus especialmente modificado que solo funciona una vez. Como una jeringa. Para hacer esto, debe cumplir con varios criterios:
Seguridad
El vector viral no debería poder multiplicarse espontáneamente. Para esto, tienen un interruptor de interrupción incorporado. Su genoma está inicialmente tan dañado que no pueden reproducirse de forma autónoma. En un entorno de laboratorio, se multiplican en cultivo celular solo en presencia de componentes insustituibles y virus auxiliares adicionales que producen parte de las proteínas necesarias para el ensamblaje. Es decir, se multiplica en un frasco de cultivo de laboratorio, pero en el cuerpo funciona una vez, deja la célula en forma semiensamblada y muere.
Baja citotoxicidad
Muchos virus son muy crueles con las células huésped. Después de la fase de incubación, la célula muere por agotamiento y los nuevos viriones se dispersan de sus restos mortales en todas direcciones. Al mismo tiempo, existen virus que no afectan especialmente a la fisiología normal de las células en las que parasitan. Por ejemplo, adenovirus.
Estabilidad
Los virus deben ser genéticamente estables. Por ejemplo, la gripe no funcionará. No tiene ningún mecanismo inteligible de "paridad" y no le importa que el hash después de copiar no converja. Esta es su estrategia evolutiva. Los mismos coronavirus, por el contrario, poseen mecanismos de control y reparación, lo que le da mayor estabilidad al material genético. Aunque no se utilizan como vector por otros motivos. Por lo tanto, la tarea es garantizar que el virus en el proceso de su reproducción en biorreactores conserve la misma carga útil, la carga útil sin cambios.
Especificidad del tipo de célula
El virus debe entregar su carga no solo en cualquier lugar, sino exactamente en un tipo específico de células. Esto significa que si necesitamos curar una enfermedad asociada con eritrocitos defectuosos, entonces el virus debe infectar con mucha precisión las células madre precursoras multipotentes de las células sanguíneas. Y al mismo tiempo, no enganche, por ejemplo, tejido muscular.
Lo que ya se está haciendo en términos de terapia génica
La primera corrección genética humana se llevó a cabo en 1990. Ashanti DeSilva, de 4 años, recibió tratamiento por un defecto genético severo de inmunodeficiencia combinada compleja asociada con una deficiencia de la enzima ADA. Cabe señalar que no se editó el genoma de las células madre que producen linfocitos T, sino las células T adultas de la sangre de su propio donante. Es decir, necesitaba repetir estos procedimientos en el futuro. Luego hubo una serie de protocolos experimentales exitosos para el tratamiento de SCID (Inmunodeficiencia combinada severa) utilizando una técnica similar.
En 1999, ocurrió un incidente que ralentizó significativamente la investigación en esta área. Jesse Gelsinger, sufría de una enfermedad hepática genética debido a la cual no pudo desintoxicar el amoníaco. 4 días después de la introducción de un vector adenoviral con una copia sana del gen, falleció como resultado de una respuesta hiperinmune y falla orgánica múltiple. Posteriormente, la FDA concluyó que hubo numerosas violaciones en el protocolo del estudio.
En 2006, aparecieron los primeros informes de protocolos de terapia génica individuales exitosos para el tratamiento de la oncología. Las células T asesinas se programan para un tipo específico de tumor y luego se liberan en el cuerpo del paciente. Terapia contra el VIH reconocida
en 2011 en el paciente Gero Hütter en 2008. El método no es particularmente aplicable a una amplia audiencia, ya que requiere la extracción completa de la médula ósea y luego la implantación de células corregidas con una doble mutación delta-32 que desactiva el receptor CCR5.
En 2013, solo había cinco medicamentos genéticos autorizados en el mundo. Tres de oncología, glybera para el tratamiento del déficit hereditario de lipoproteinlipasa y neovasculgen. Este último, por cierto, fue desarrollado completamente por nosotros.
Neovasculgen
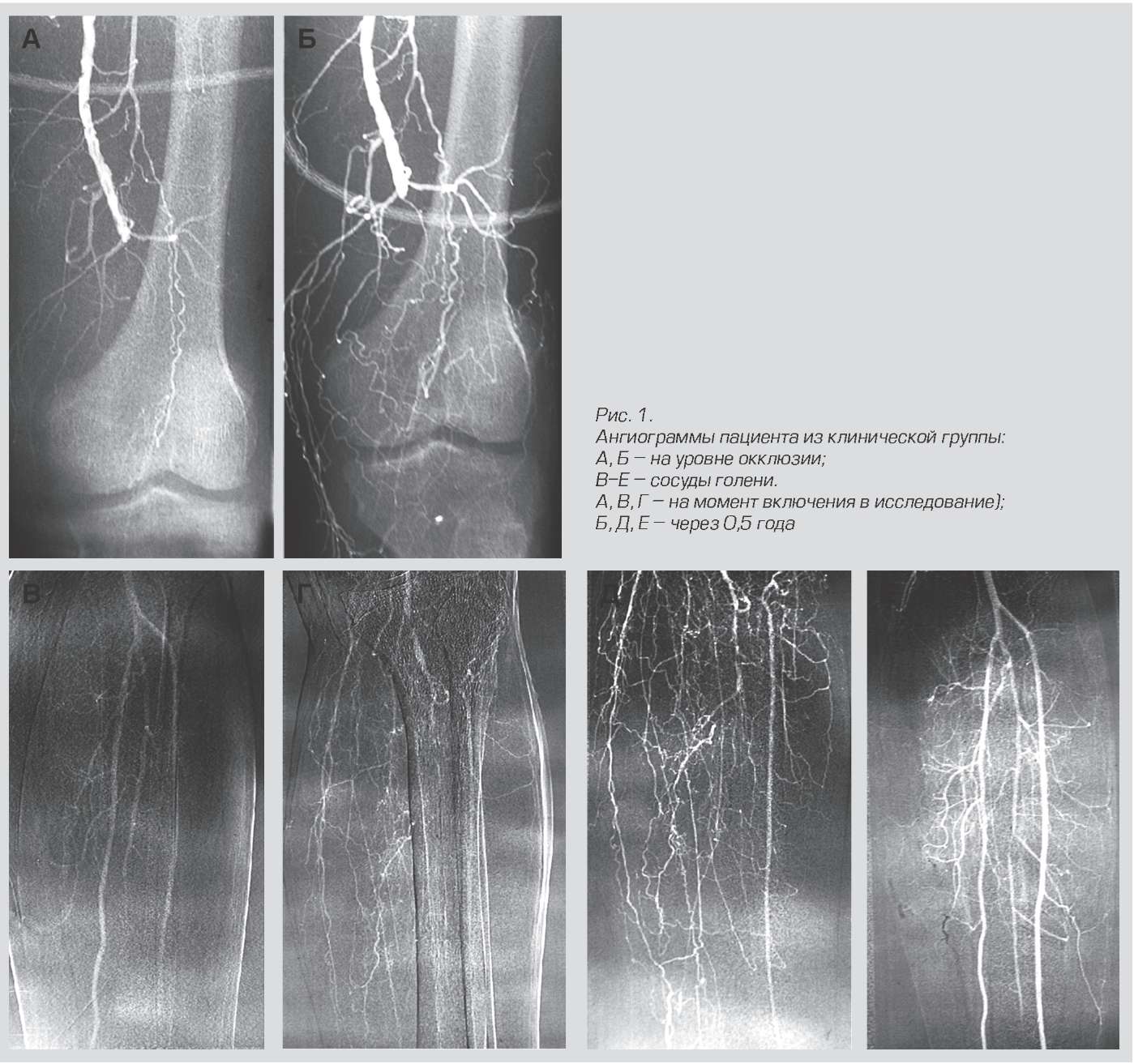
Resultados del tratamiento con Neovasculgen.
Este medicamento pertenece al plásmido, es decir, no edita su propio genoma de la célula, sino que solo le entrega plásmidos que funcionan durante un tiempo limitado.
(), VEGF 165, (VEGF — Vascular Endothelial Growth Factor). , . , , .
Instituto de células madre humanas
El mecanismo de acción es interesante. Las células en el lugar de la inyección comienzan a sintetizar VEGF, un factor de crecimiento vascular. Como resultado, una nueva red capilar ramificada comienza a crecer en esta área. Esto es fundamental para pacientes con isquemia crónica de miembros inferiores debido a diabetes y aterosclerosis, por ejemplo. Antes de esta droga había más amputaciones. Ahora también se ha probado para su uso en odontología para el injerto de implantes. La preparación del gen se mezcla con material óseo y se sutura. Como resultado, los vasos crecen rápidamente y se forma el tejido necesario sin rechazo. Los conejos ya se han simulado con precisión durante el trasplante de fragmentos de cráneo. La gente es la siguiente, hasta donde yo sé.
Zolgensma
La atrofia muscular espinal es una enfermedad muy grave, clínicamente algo similar a la esclerosis lateral amiotrófica que sufrió Hawking, pero tiene otras causas. Como resultado del desarrollo de la enfermedad, progresa la parálisis, que termina en la muerte debido a la incapacidad para respirar.
Zolgensma es el primer fármaco de terapia génica para la atrofia muscular espinal. Producida por AveXis (Novartis). Se inyecta una copia de trabajo del gen SMN utilizando virus adenoasociado (AAV) serotipo 9, AAV9, que puede atravesar la barrera hematoencefálica y entrar en las células del paciente. Un problema: cuesta un dinero absolutamente monstruoso. Una inyección cuesta más de 2,1 millones de dólares (unos 152 millones de rublos). Pero los resultados también son asombrosos. En los humanos, la función motora se restaura y la enfermedad no progresa más. En teoría, el estado debería pagar esas costosas manipulaciones. Para las personas, el costo del tratamiento de enfermedades raras es simplemente prohibitivo.
¿Que sigue?
He aquí una pregunta muy difícil. Acumulamos genes defectuosos en la población. Anteriormente, un niño con un defecto cardíaco simplemente moriría; ahora lo salvarán y le dará descendencia con este defecto. Anteriormente, muchos embarazos no duraban; ahora, las mujeres embarazadas se retiran con un porcentaje mínimo de abortos espontáneos y se completan con partos exitosos. De hecho, estamos rompiendo los mecanismos del sacrificio natural de poblaciones. Esto es correcto y humano, pero hay que hacer algo con la acumulación de mutaciones del acervo genético.
O llegaremos a las tarjetas verdes y los permisos de reproducción, o aprenderemos cómo corregir las anomalías genéticas de manera confiable y segura. Sería genial descartar la miopía, la displasia sistémica del tejido conectivo y muchos otros defectos de nacimiento. Y finalmente, arregla ese estúpido gen roto responsable de la síntesis de vitamina C a partir de glucosa, como todos los mamíferos normales.
Aquí solo nos espera un futuro desconocido. Lo más alarmante es la estratificación potencial de la sociedad, cuando los segmentos más ricos de la población modifican a sus hijos para que estén libres de diabetes, aterosclerosis y al mismo tiempo aplastan un poco de miostatina para que parezcan atléticos sin mucho esfuerzo. Fresco. Pero da miedo.
