
La vida humana según los estándares del Universo es solo un instante, y según los estándares de un vuelo nocturno es una eternidad. Para nosotros, la valoración de la duración de nuestra propia trayectoria vital se complica por los acontecimientos que ocurren en el proceso, las personas que conocemos y de las que nos separamos, las emociones que experimentamos. Después de todo, cuanto más complejo es el cerebro de una criatura, más compleja es su autoconciencia. Sin embargo, cualquier camino está determinado no solo por su saturación, sino también por el hecho de que termina tarde o temprano. Durante muchos siglos, la gente ha intentado responder a la pregunta de qué hay más allá de los límites de la vida, y nadie tiene una respuesta categórica clara. Sin embargo, "antes" sigue siendo no menos misterioso y misterioso que "después". Científicos del Museo Americano de Historia Natural (Nueva York, EE. UU.) Realizaron un estudio,que describe una posible variante del origen de moléculas orgánicas hace miles de millones de años. ¿Qué pudo haber sido el comienzo de la vida en el planeta, dónde sucedió y cómo puede este conocimiento ayudar a comprender nuestro mundo aquí y ahora? Las respuestas a estas preguntas están ocultas en el informe de los científicos. Vamos.
Base de investigación
Como se mencionó anteriormente, no se sabe con certeza qué le espera a una persona o cualquier otro organismo vivo después de que su cuerpo pierde su vitalidad. Esta pregunta la hacen físicos, biólogos, teólogos y filósofos. Todos tienen respuestas, cada una de las cuales tiene derecho a existir, pero estas son solo teorías que aún no han sido confirmadas empíricamente por razones obvias.
En cuanto a lo que sucedió antes de que todo comenzara, esta pregunta es igualmente compleja y controvertida. La teoría del Big Bang nos dio la idea del origen del universo, pero quedan dudas sobre lo que vino antes. La teoría evolutiva de Darwin ayudó a comprender cómo las especies de nuestro planeta están interconectadas, cómo evolucionaron, cómo una se transformó en otra. Pero incluso aquí surgen preguntas: qué o quién fue el primero, por qué nació la vida, en qué circunstancias, fue este evento por casualidad o fue el gran plan de alguien. Preguntas de siglos, no de otra manera.
Sin embargo, el conocimiento que posee el hombre moderno puede servir como herramienta para construir la cadena de eventos que llevaron al nacimiento de la vida. Sabemos que el hidrógeno, el nitrógeno y el oxígeno son elementos fundamentales en el origen y mantenimiento de la vida. En la vida moderna, la mayoría de las moléculas orgánicas se forman mediante la reducción de dióxido de carbono (CO 2 ) a través de varias vías de "fijación de carbono" (por ejemplo, la fotosíntesis en las plantas). Pero la mayoría de estas vías requieren energía de la célula o aparecieron relativamente tarde. Surge la pregunta: ¿qué pasó antes?
Según los científicos, una de las vías para la formación de materia orgánica podría ser la reducción del CO 2 con ayuda del H 2 . Los estudios geológicos muestran que el CO2 se encontró en concentraciones relativamente altas en el océano durante el katarchean * , mientras que el H 2 fue producto de múltiples procesos en la corteza terrestre y fue liberado al exterior por respiraderos hidrotermales.
Katarchei * es un eón (período de tiempo) geológico que duró los primeros 600 millones de años de existencia de la Tierra.En consecuencia, en la unión de dos ambientes (el océano y la corteza terrestre), surgió una reacción entre dos gases disueltos, que condujo a la formación de hidrocarburos, que posteriormente jugaron un papel importante en la transición de la geoquímica a la bioquímica.
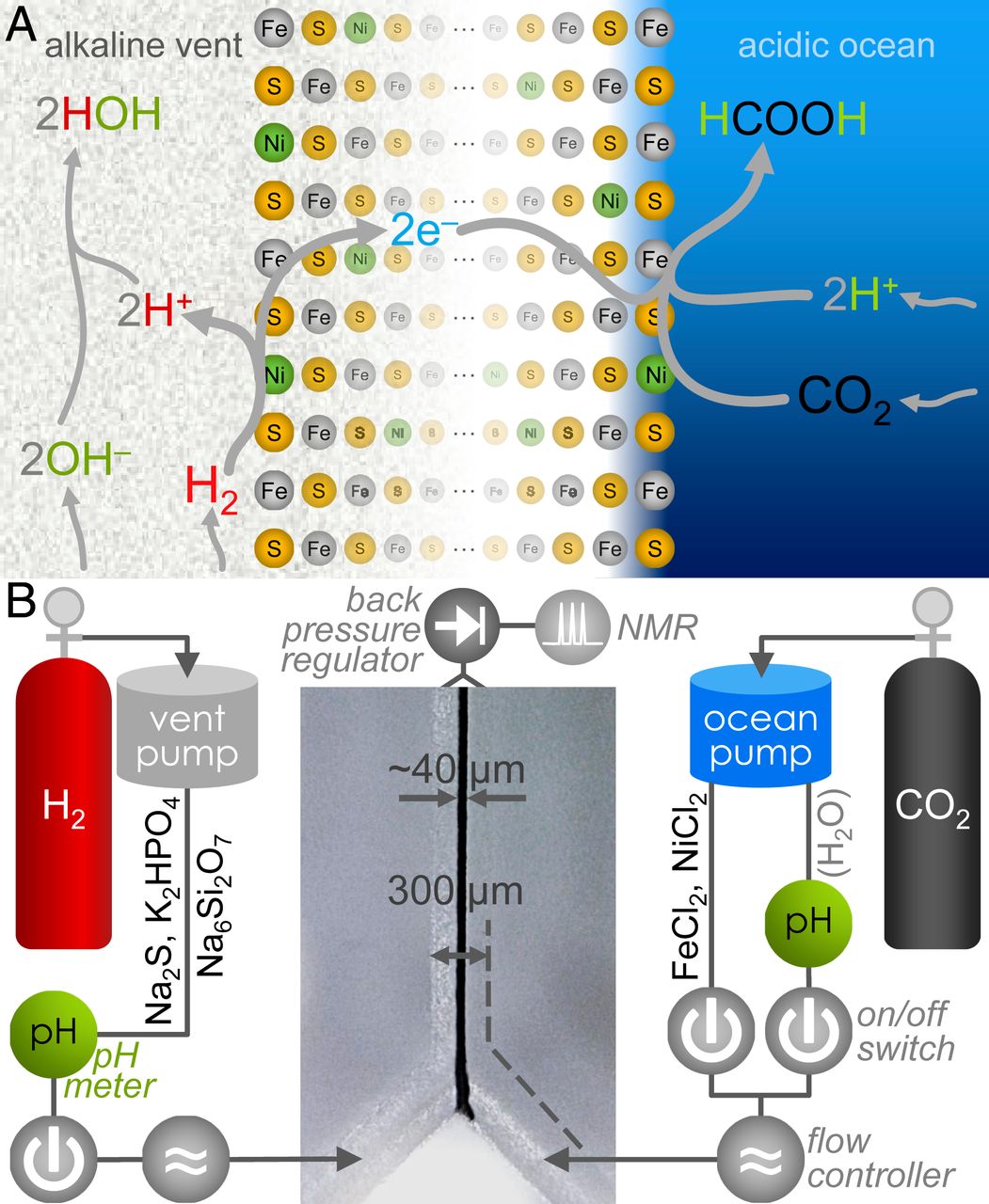
Imagen №1
En condiciones estándar (1 a, 25 ° C, pH 7), la reacción entre CO 2 y H 2 con la formación de formiato (HCOO - ) es termodinámicamente desfavorable con ΔG 0 ' = + 3,5 kJ / mol. Sin embargo, en los resortes alcalinas antiguos ( 1A ), H 2 fue presente en OH - ricas aguas de una fuente hidrotermal, que contribuyó a su oxidación en el agua. Además, el CO 2se disolvería en un océano relativamente ácido, lo que facilitaría la protonación en su reducción a HCOO - .
Con la ayuda de los minerales Fe (Ni) S depositados en la interfaz entre el océano y la corteza, un gradiente de pH de más de tres unidades debería haber sido suficiente para aumentar la viabilidad de la reacción en ~ 180 mV, lo que la hace favorable para la formación orgánica.
Una vez formado, el formiato tendría un potencial químico abiótico suficiente. Por ejemplo, se sabe que los grupos formilo forman compuestos intermedios del ciclo reductor de los ácidos tricarboxílicos * y la vía reductora de Acetil-CoA * , lo que sugiere una posible vía para el desarrollo del metabolismo biológico.
* — .
- ( - WL-)* — , 2 .Otra teoría sugiere que cuando se calienta en presencia de amoníaco, que también es un componente putativo de las aguas alcalinas, el formiato forma formamida [HC (O) NH 2 ], una molécula altamente reactiva que es la piedra angular de una de las teorías del origen de la vida ( Formamida y el origen de la vida). ). La reacción posterior de esta mezcla da cianuro de hidrógeno (HCN), que también es la base de otra teoría de la formación de materia orgánica ( Orígenes comunes de ARN, precursores de proteínas y lípidos en un protometabolismo cianosulfídico ). A su vez, la deshidratación del formiato conduce a la formación de monóxido de carbono (CO) ( ácido acético activado por fijación de carbono en (Fe, Ni) S en condiciones primordiales). Como puede ver, existen muchas teorías sobre el origen de los compuestos orgánicos, y cada una de ellas tiene explicaciones bastante lógicas.
Aunque había varias fuentes de carbono reducido en la Tierra primitiva y muchos entornos posibles para productos químicos ricos, el escenario hidrotermal alcalino descrito anteriormente es mucho más interesante para los científicos debido a su similitud con la vía WL de fijación de carbono.
Un argumento adicional a favor de la importancia potencial del escenario hidrotermal alcalino para la formación de materia orgánica es el hecho de que el proceso WL es la única de las seis vías biológicas conocidas para la fijación de carbono que libera energía en general, en lugar de consumirla, y sus variaciones están presentes en representantes existentes de ambas arqueas ( metanógenos *) y bacterias ( acetógenos * ).
Los metanógenos * son arqueas que forman metano como subproducto del metabolismo en condiciones anóxicas.
Los acetógenos * son bacterias que liberan acetato (CH 3 COO - ) como producto final de la respiración anaeróbica o la fermentación del homoacetato.El primer paso en esta dirección es la reducción de CO 2 con H 2 para formar formiato (HCOO - o su equivalente electrónico deshidratado, es decir, CO).
Esta reacción es endergónica * , por lo que algunos miembros de arqueas y bacterias utilizan la bifurcación de electrones * o la quimiosmosis * a través de la membrana celular para desencadenar este proceso.
Reacciones endergónicas * : reacciones químicas que requieren energía del exterior para su curso.
Bifurcación de electrones * : mecanismo de separación de electrones en una reacción redox.
Quimiosmos * : transformación de la energía de la cadena de transporte de electrones en energía de ATP (trifosfato de adenosina).Sin embargo, en ausencia de mecanismos de fusión celular como la bifurcación de electrones o la quimiosmosis, esta primera etapa endergónica es un cuello de botella de energía clave en la vía WL y sigue siendo una cuestión abierta importante en los estudios sobre el origen de la fijación biológica de carbono.
En este estudio, los investigadores demostraron la reducción indirecta abiótica de CO 2 a HCOO , utilizando un gradiente de pH inducido por H 2 en los sedimentos microfluídicos Fe (Ni) S, a través de un mecanismo que se asemeja a una trayectoria de flujo de electrones WL separados.
Resultados de la investigacion
En primer lugar, se preparó un equivalente de laboratorio de un medio hidrotermal alcalino con una simulación de la interfaz entre la corteza terrestre y las aguas del océano. El componente alcalino incluía Na 2 S (100 mM), K 2 HPO 4 (10 mM) y Na 2 Si 3 O 7 (10 mM) en agua desaireada. El análogo del océano incluía FeCl 2 (50 mM) y NiCl 2 (5 mM). Ambos líquidos se alimentaron a un reactor de microfluidos de borosilicato en forma de Y ( 1B ).
La presión ambiental de H 2 y CO 2 fue insuficiente para reducir las emisiones de CO 2por lo tanto, en lugar de intentar disolver cualquier gas burbujeando * antes de la reacción, se decidió utilizar bombas de microfluidos que funcionan con presión de gas.
Burbujeo (burbujeo) * : el proceso de pasar gas a través de una capa de líquido.El líquido alcalino fue empujado fuera por H 2 a una presión de 1,5 bar, y el análogo de océano fue empujado fuera por CO 2 a la misma presión.
Cada ciclo del reactor se dividió en dos etapas sucesivas: primero, para la deposición de depósitos de Fe (Ni) S en la unión (en la interfaz) de dos líquidos; el segundo ("posprecipitación") - para intentar crear una reacción entre el CO 2 y el H 2 (u otros reactivos).
Como resultado de la interacción de un líquido alcalino y un análogo oceánico durante 15-60 segundos en la etapa de precipitación, se formó un sedimento con un ancho de 30 a 60 μm en la interfaz entre dos líquidos, visible bajo un microscopio óptico digital (en el centro en 1B). La eliminación de metales del lado análogo del océano después de la precipitación impidió un aumento de sedimentos hasta el valor crítico del cierre del canal del reactor.
Después de la formación de sedimentos y para evitar la obstrucción de los canales de microfluidos por sedimentación adicional en la segunda etapa, el fluido oceánico se cambió a agua limpia desaireada desplazada por CO 2 (a la derecha en 1B ). En este caso, el análogo del líquido alcalino permaneció igual con Na 2 S, K 2 HPO 4 y Na 2 Si 3 O 7 expulsado por H 2 .
A continuación, se determinó el nivel de pH de los líquidos entrantes en el punto de entrada: el análogo del océano - pH 3,9, aguas alcalinas - pH 12,3. A una velocidad de flujo de 5 μL / min para cada entrada, el tiempo de residencia de los líquidos en el canal central fue de ~ 3.3 s, por lo que se dejó que el sistema funcionara durante al menos 2 minutos antes de recopilar los datos de salida. A continuación, se recogió la salida total del reactor (mezcla líquida) y se analizó mediante espectroscopía de RMN. El análisis mostró que el valor promedio de la concentración de HCOO - fue de 1,5 μM.

Tabla 1: resultados experimentales.
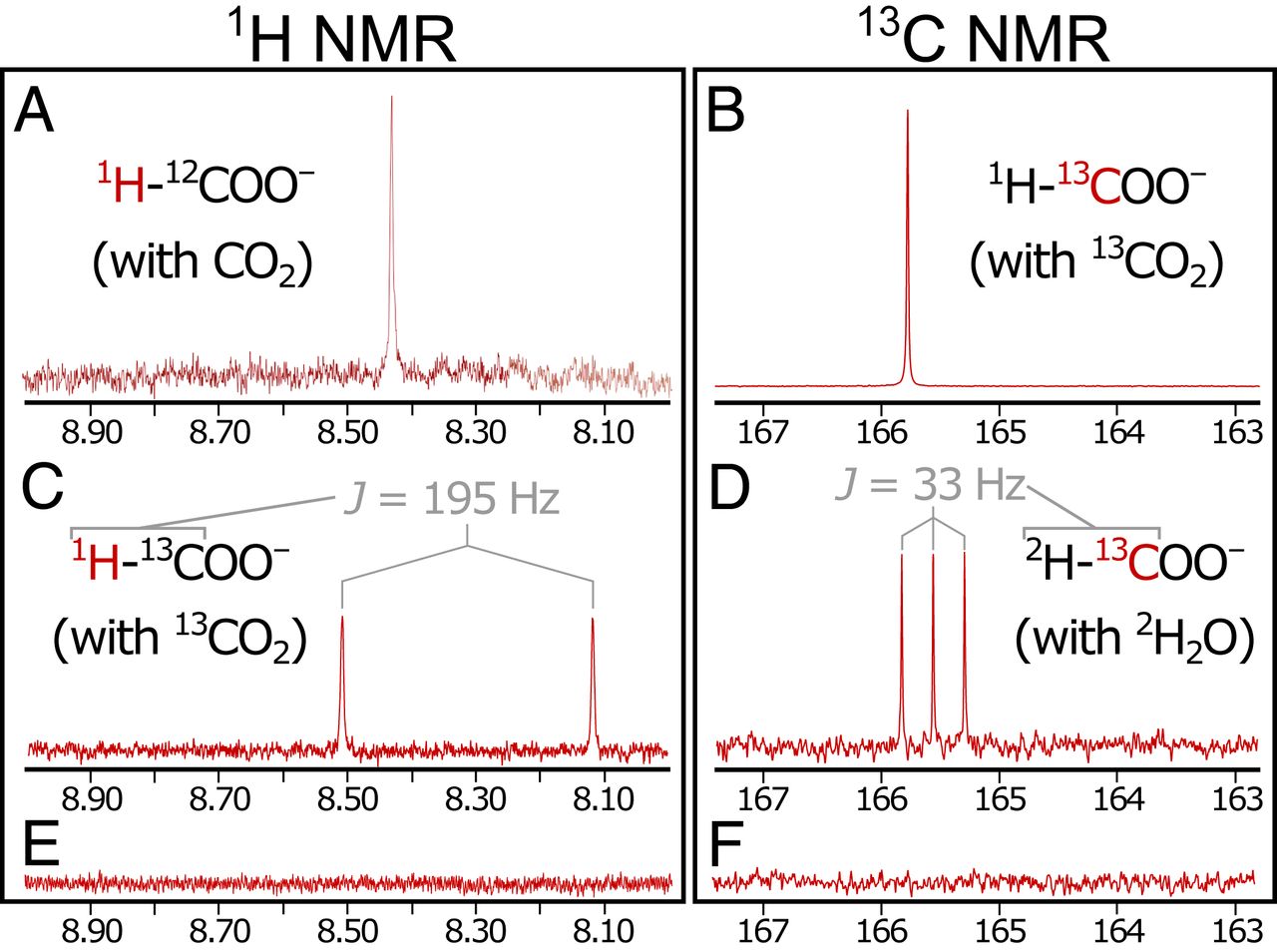
Imagen # 2
Picos singlete en espectros de RMN 1 H (8,42 ppm; 2A ) y 13C NMR (165,8 ppm) corresponde a muestras de ácido fórmico puro (> 98%). Al realizar las etapas de precipitación y reacción con 13CO 2 enriquecido isotópicamente (99% 13 C) (experimento 2) se obtuvo un singlete más fuerte en el espectro de 13 C (165.8 ppm; 2B ) y la división esperada del singlete de formilo en un doblete (una señal dividida en dos picos) en espectro 1 H (J = 195 Hz) debido a la interacción de 1 H - 13 C en el grupo formilo ( 2C ). Resulta que se requiere H 2 para reducir las emisiones de CO 2 . Con líquido en el lado de salida controlado por N 2 en lugar de H 2
(es decir, en ausencia de H 2 tanto durante como después de la precipitación), no se detectaron productos de reducción (experimento 3; 2E y 2F ).
Para una comprensión más detallada del proceso en curso, se realizaron experimentos adicionales sobre el etiquetado con deuterio ( 2 H o D) (experimentos 4 y 5) utilizando variantes isotópicas en todos los experimentos.
Independientemente de si se utilizó H 2 sin etiquetar (Experimento 1) o D 2 (Experimento 4) para controlar la bomba en el lado del líquido alcalino, solo se observó HCOO marcado no isotópico , una salida de fluido. Esta observación sugiere que la reducción de CO2 pueden ocurrir exclusivamente en el lado del océano.
Por el contrario, con D 2 O utilizado en lugar de H 2 O convencional en el lado del océano y con H 2 sin etiquetar que impulsa una bomba en el lado del líquido alcalino (Experimento 5), se encontró formiato exclusivamente deuterado (DCOO - ), como lo demuestra triplete a 13 C NMR (J = 33 Hz) y sin otros picos perceptibles ( 2D ). Esto confirma además que la reducción de CO 2 corresponde a la composición isotópica en el lado del océano y no en el lado de la corteza.
En la siguiente etapa del estudio, se probó el papel del gradiente de pH del sistema hidrotermal alcalino submarino simulado. Las reducciones exitosas de CO 2 que se muestran en la Tabla 1 ocurrieron a un pH análogo del océano de 3.9 y un pH análogo de descarga de 12.3.
Al mezclar, este ∆pH inicial de 8.4 unidades inevitablemente disminuiría, pero los gradientes de pH de varias unidades se mantienen exitosamente a lo largo del tiempo en escalas de microfluidos, especialmente en presencia de precipitado en la interfaz.
Era necesario comprender si se requiere tal gradiente de pH en el sistema de reducción para facilitar la oxidación de H 2 en el lado alcalino y la reducción de CO 2 en el lado ácido ( 1A). Después de la sedimentación en las mismas condiciones que para el experimento 1, se evaluaron los efectos de diferentes niveles de pH y composición de cada uno de los dos líquidos (tabla # 2). Sustitución de la fuente alcalina simulante con pura H 2 O impulsado por H 2 no funcionaba (Tabla 2, Experimento 6).
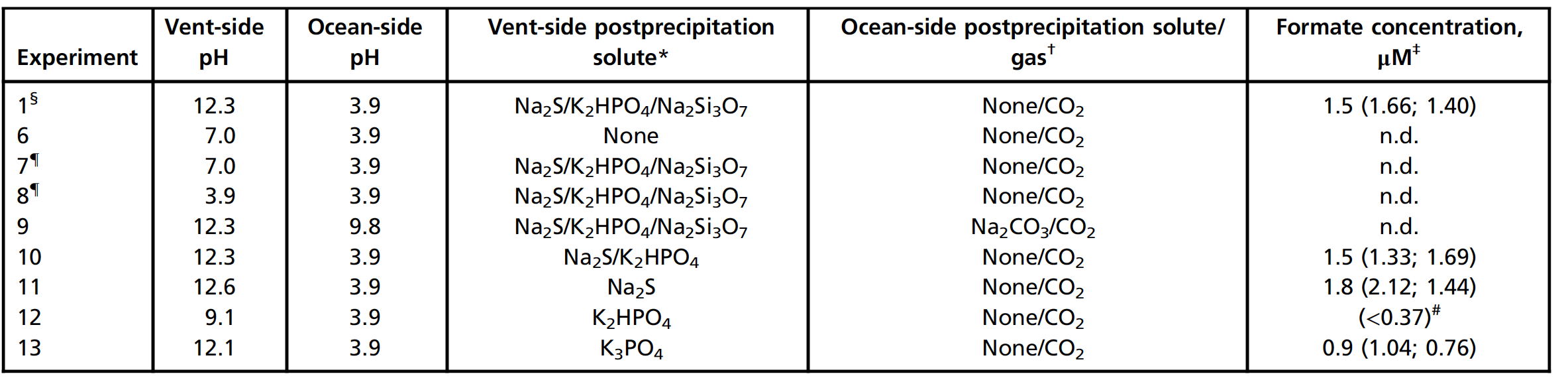
Tabla 2: resultados de experimentos con diferentes valores de pH.
Asimismo, la acidificación del líquido análogo de la fuente alcalina con HCl a pH 3,9 y pH 7,0 no condujo a la formación de formiato (experimentos 7 y 8).
Adición de 100 mM de Na 2 CO 3 al líquido oceánico mientras se usa CO 2como gas propulsor (Experimento 9) elevó el pH del océano a 9,8 y no se encontró ningún producto en estas condiciones. La eliminación del silicato del lado de la fuente después de la precipitación todavía produjo formiato (Experimento 10), al igual que la eliminación del silicato y el fosfato con solo Na 2 S (Experimento 11).
Con solo K 2 HPO 4 después de la deposición en el lado de la fuente alcalina, solo se detectaron cantidades residuales de formiato (por debajo del límite de cuantificación de 0,37 μM), posiblemente debido a un pH alcalino insuficiente de 9,1 (Experimento 12). Por otro lado, el K 3 PO 4 más alcalino elevó el pH a 12,1 y condujo a la formación de una cantidad significativamente mayor de formiato (Experimento 13).
Los científicos dicen que no pueden descartar completamente la posibilidad de que el sulfuro de precipitado-bound actúa como un agente reductor, además de H 2 . Sin embargo, los resultados anteriores confirman simultáneamente el papel del gradiente de pH y muestran que no se requiere una alimentación continua de sulfuro acuoso en el sistema.
La eliminación de Ni del fluido sedimentario del océano (Experimento 14) resultó en la formación de solo una pequeña cantidad de formiato. Por el contrario, reemplazar Fe para dejar Ni como el único metal en el fluido sedimentario del océano (NiCl 2 , 55 mM; experimento 15) produjo 1,4 μM de formato, lo que indica un papel decisivo para el Ni en la precipitación.
Eliminación de FeCl 2 y NiCl 2del fluido oceánico, como se esperaba, no condujo a la formación de formiatos y sedimentos detectables (Experimento 16).
Los científicos creen que la explicación más adecuada de lo que está sucediendo es el proceso electroquímico ( 1A ), pero existen varios mecanismos alternativos para reducir las emisiones de CO 2 asociadas a la oxidación del H 2 , que son menos probables.
Uno de estos mecanismos puede llamarse el "más simple", pero también el menos homólogo bioquímicamente: la reducción de carbono debido a la hidrogenación directa ( 3A - 3C ). En este caso, el hidrógeno de H 2 se transferirá directamente a CO 2ya sea como hidrógeno atómico (hidrogenación clásica) o como hidruro (hidrogenación iónica).
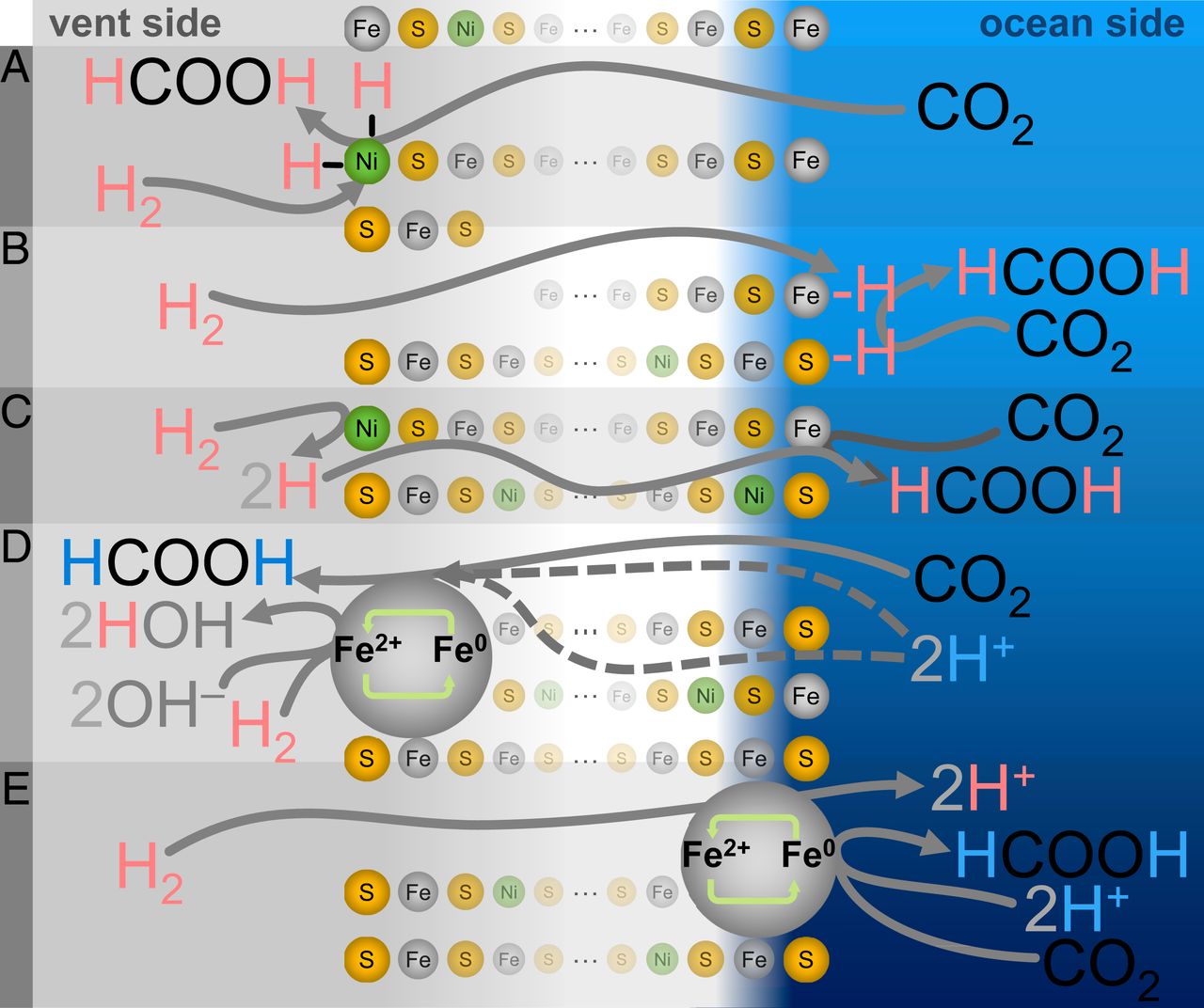
Imagen # 3
En otras palabras, la salida de dicho mecanismo debe corresponder a la firma isotópica del gas H 2 / D 2 liberado . En cambio, el formiato producido en este caso coincide solo con la composición isotópica del agua en el lado del océano, independientemente de la composición del gas o agua en el lado de la fuente hidrotermal.
En los mecanismos de hidrogenación directa, las partículas de hidrógeno adsorbidas pueden intercambiarse con el líquido circundante de modo que se pierda la firma isotópica original. Sin embargo, cualquier proceso de este tipo implica la migración de una cantidad significativa de líquido a través del sedimento. La mezcla sustancial de líquidos debería haber causado una señal mixta de H / D de formilo, que no se observó en experimentos prácticos, excluyendo completamente la hidrogenación.
Otra posible opción es que los átomos de hidrógeno en el formiato resultante no provengan directamente del H 2 . En cambio, el mecanismo se puede llevar a cabo mediante el ciclo redox del átomo de Fe o Ni de borde o esquina (M 2+ ⇄ M 0 ), en el que el metal se reduce primero por H2 (dejando dos protones para la dilución), y luego el metal transfiere los electrones adquiridos a CO 2 con la eliminación de protones del medio acuoso local ( 3C - 3E ).
Sin embargo, este escenario es difícil de comparar con los valores de pH reales que se encontraban durante los experimentos. El pH de 3.9 se consiguió únicamente mediante la disolución de CO 2 en agua. Por lo tanto, cualquier protón del lado del océano debería ocurrir como resultado de la disociación del ácido carbónico a través de:
H 2 O + CO 2 ⇌ H 2 CO 3 ⇌ H + + HCO - 3
Cuando se llevó a cabo la reacción usando D 2 O (experimento 5) como disolvente en el lado del océano, solo se encontró DCOO - en el efluente . De esto se deduce que la reducción de CO 2 no se produjo en el lado de la fuente donde estaban presentes agua ordinaria (H 2 O) y H 2 . Puede haber varios
escenarios para un ciclo redox localizado ( 3D y 3E ), pero como todos requieren una colocación conjunta, ninguno de ellos puede ofrecer una firma isotópica exclusivamente en el lado del océano, que se observó durante los experimentos.
Combinado con la fuerte dependencia del pH de la reacción, estos resultados sugieren que la reducción del CO 2 ocurre a través de un mecanismo electroquímico, en el cual los electrones de la oxidación del H 2 en el lado de la fuente alcalina se mueven a través de la precipitación de Fe (Ni) S hacia el CO 2 en el lado del océano. ( 1A ).
Los procesos anteriores no podrían haber tenido lugar si no hubiera un mecanismo para activar y mantener la interacción entre el agua del océano y los respiraderos hidrotermales alcalinos. Además, surge la pregunta con respecto a la "vitalidad" de los compuestos orgánicos formados, ya que simplemente podrían disolverse en el agua del océano antes de asumir cualquier función bioquímica.
La respuesta a la primera pregunta puede ser el efecto Venturi * causado por el aumento de la porosidad de la estructura de los respiraderos hidrotermales. Una vez dentro del respiradero, el dióxido de carbono del océano puede reaccionar con los electrones transportados a través de los minerales catalíticos del canal de ventilación hidrotermal, y también pueden aparecer nuevos sedimentos en el tiempo cuando los dos líquidos entran en contacto.
Efecto Venturi * : la caída de presión cuando una corriente de líquido o gas fluye a través de una parte estrecha de una tubería.El modelado de esta teoría mostró que en el caso de un reactor experimental de 300 μm de ancho, realmente ocurre la fusión microfluídica de dos reactivos, lo que se demostró en el curso de experimentos prácticos.
Los científicos también señalan que este efecto no se limita a los respiraderos alcalinos subacuáticos y es probable que ocurra en sistemas hidrotermales porosos en cualquier lugar y profundidad, lo que permite muchos escenarios geoquímicos para el origen de la vida.
Cabe señalar que el sistema de microfluidos para la reducción de CO 2 con ayuda de H2 no es el único. También existe una técnica que utiliza un sistema periódico de un solo canal.
Otros minerales (Fe 3 Ni), mayor presión (10 bar para H2 ) y temperaturas más altas (100 ° C) que en los experimentos realizados, el sistema discontinuo permite obtener mucho más formiato, así como varios productos de reducción adicional (acetato, metanol y piruvato). Además, la tasa de producción de formiato (5,21 x 10 -9 mol / s) es cuatro órdenes de magnitud más alta que la tasa alcanzada por el sistema de microfluidos.
La importancia del sistema periódico radica en el hecho de que sus resultados confirman el desempeño del sistema microfluídico. Esto confirma la teoría sobre la existencia de materia orgánica en las condiciones de respiraderos hidrotermales alcalinos anóxicos.
Para un conocimiento más detallado de los matices del estudio, recomiendo mirar el informe de científicos ymateriales adicionales .
Epílogo
Todo lo que tiene un comienzo tiene un final. Estas palabras, dichas por Pythia de la película "Matrix", en una interpretación u otra, fueron dichas por verdaderos filósofos y científicos mucho antes del lanzamiento de esta película. Además, uno de los principios fundamentales de la ciencia se recuerda del curso de química escolar: nada desaparece en ningún lado y no se saca de ningún lugar sin dejar rastro. Con lo que sucederá al final, o más bien después, la humanidad tendrá que lidiar con eso durante mucho tiempo. Pero ya existe cierta comprensión de lo que fue al principio.
En este estudio, los científicos describieron una posible variante de la formación de los primeros compuestos orgánicos. En su opinión, este proceso tuvo lugar en la unión de las aguas del océano y los manantiales hidrotermales. Durante los experimentos, fue posible convertir CO 2 en moléculas orgánicas mediante H 2y pH controlado.
Este resultado no solo explica los orígenes de la vida en nuestro planeta, sino que también puede utilizarse en el desarrollo de instrumentos para reducir las emisiones de CO 2 , que es un problema muy angustioso del mundo moderno. Entre otras cosas, comprender cómo aparecieron los orgánicos en la Tierra nos permite construir teorías más rentables sobre la posible presencia de estos en otros planetas como el nuestro.
Si cambiamos a una ola más filosófica, entonces podemos decir con confianza que este trabajo demuestra la importancia de comprender el pasado para la formación exitosa del futuro. La historia está repleta de investigaciones, que los contemporáneos llamaron curiosidad ociosa y pérdida de tiempo. La gran mayoría de ellos resultó ser mucho más importante de lo que nadie hubiera imaginado. La conclusión es simple: en ciencia, es necesario buscar respuestas a todas las preguntas, sin importar cuán estúpidas puedan parecer a primera vista.
Gracias por su atención, mantengan la curiosidad y tengan una buena semana de trabajo, chicos. :)
Un poco de publicidad
Gracias por estar con nosotros. ¿Te gustan nuestros artículos? ¿Quieres ver contenido más interesante? Apóyanos haciendo un pedido o recomendando a amigos, VPS en la nube para desarrolladores desde $ 4.99 , un análogo único de los servidores de nivel de entrada que hemos inventado para usted: Toda la verdad sobre VPS (KVM) E5-2697 v3 (6 núcleos) 10GB DDR4 480GB SSD 1Gbps desde $ 19 o cómo dividir el servidor correctamente? (opciones disponibles con RAID1 y RAID10, hasta 24 núcleos y hasta 40GB DDR4).
¿Dell R730xd es 2 veces más barato en el centro de datos Equinix Tier IV en Ámsterdam? ¡Solo tenemos 2 x Intel TetraDeca-Core Xeon 2x E5-2697v3 2.6GHz 14C 64GB DDR4 4x960GB SSD 1Gbps 100 TV desde $ 199 en los Países Bajos!Dell R420 - 2x E5-2430 2.2Ghz 6C 128GB DDR3 2x960GB SSD 1Gbps 100TB - ¡Desde $ 99! Lea sobre Cómo construir la infraestructura de bldg. clase con el uso de servidores Dell R730xd E5-2650 v4 a un costo de 9000 euros por un centavo?