
Si está interesado en biología, especialmente si está impartiendo esta asignatura, le será útil mi artículo sobre la preparación y realización de trabajos de laboratorio para identificar un gen genéticamente extraño en el ADN de los alimentos.
La controversia en torno a los OGM, así como las incesantes discusiones científicas y éticas sobre la legitimidad de la intervención humana en los "asuntos de la Naturaleza / Dios", se dejarán en manos de los filósofos. Solo afirmamos que la competencia profesional de un biólogo, biotecnólogo, bioinformático y genética modernos es inconcebible sin la capacidad de investigar y, si es necesario, cambiar genes. Ya en la escuela, y luego en la universidad, los experimentos y experimentos biotecnológicos requieren que los alumnos y estudiantes establezcan tareas claras, comprendan la metodología del experimento y la capacidad de analizar datos. Todo esto desarrolla la curiosidad y la confianza, y crea una base para el estudio adicional de cuestiones y problemas asociados con la investigación científica. Mi PLAN-CONSPECTbasado en 3 pruebas realizadas con reactivos BioRad y equipo estándar requerido para análisis de PCR. Pero, por supuesto, cualquier otro KIT se puede utilizar para detectar OMG. Todos los matices del experimento (protocolos) se describen en detalle en la documentación que acompaña a los reactivos, por lo que no me detendré en ellos en detalle. Entonces, el esquema del plan tiene 2 nombres: PLAN - porque se requiere planificar clara y minuciosamente el contenido de la lección, y CONSPECCIONAR - porque es necesario pensar de antemano qué material enseñar a los niños y en qué enfocarse para revelar completamente el propósito del experimento.
Plan
La experiencia está diseñada para dos sesiones.
Lección uno:
1. Familiarización teórica de los estudiantes con los conceptos básicos de la estrategia de detección de OGM (objetivos de detección e identificación).
2. Aislamiento del ADN de los alimentos (un escolar o estudiante trae cualquier producto de su elección).
3. Realización de la reacción en cadena de la polimerasa.
Segunda lección:
4. Electroforesis en gel y discusión.
5. Comentarios finales del maestro.
Abstracto
Primera lección
1. ¿De dónde provienen los nuevos genes y elementos auxiliares (15-20 minutos)
Los organismos genéticamente modificados son organismos que tienen una combinación extraña de material genético obtenido mediante biotecnología moderna. Por ejemplo, al usar plásmidos Ti, genes extraños y características de plantas modificadas genéticamente pueden ser genes que brindan resistencia a herbicidas (cp4, epsps, gox), resistencia a plagas (cry) o genes que cambian la calidad del producto (PG, Bay TE). Para la expresión de un gen extraño en una célula huésped, se requieren elementos genéticos adicionales:
- promotor: una secuencia de nucleótidos que es reconocida por la ARN polimerasa como un marcador del inicio de la transcripción;
- – , - ;
- - – ( ), ;
- – , , .
El diseño del plásmido también contiene un gen de cloroplasto altamente conservado del Fotosistema II, que forma parte de la reacción ligera de la fotosíntesis para confirmar que se ha extraído ADN viable y que un resultado de GM negativo no está asociado con una matriz no viable.
La identificación del ADN recombinante en los alimentos se puede realizar de varias formas, como se muestra en la Figura 1.

Figura 1. Identificación del ADN recombinante en los alimentos
Los kits de reactivos listos para usar más comunes que se utilizan para identificar productos transgénicos se basan en la identificación de un promotor y un terminador. El kit de investigación de OMG de BioRad utiliza PCR y electroforesis de ADN para comprobar la presencia de dos secuencias de ADN diferentes asociadas con los OMG: el promotor 35S del virus del mosaico de la coliflor y el terminador del gen de la nopalina sintasa de Agrobacterium tumefaciens. Estas secuencias de ADN se encuentran en> 85% de las plantas modificadas genéticamente comercializadas en todo el mundo. El nuevo gen presente en el ADN del control positivo es epsps. Como control de la integridad del ADN vegetal extraído de los alimentos, la PCR se utiliza para amplificar parte del gen del cloroplasto del fotosistema II que es común a la mayoría de las plantas superiores. Entonces, la prueba apunta a 3 objetivos: un promotor,terminador y parte del gen del cloroplasto del fotosistema II, respectivamente, en un conjunto de 3 cebadores, dos de los cuales (cebadores del promotor y del terminador) se mezclaron. Por lo tanto, hay 2 viales en el conjunto: rojo - cebadores de OGM, que se usan para determinar si el alimento contiene OGM, y verde - Fotosistema II de plantas, que se usa para determinar si el ADN se ha extraído de material vegetal.
Después del discurso introductorio, los estudiantes deben familiarizarse con el protocolo de extracción de ADN y PCR, explicar paso a paso el curso del experimento y centrarse en las características de trabajar con un KIT de un fabricante en particular.
2. Aislamiento del ADN de los alimentos (15-20 minutos)
Dependiendo de los trabajos disponibles, los niños pueden dividirse en grupos de 2-3 personas, cada una de las cuales elige un producto alimenticio de interés para su análisis. Las papas fritas o palomitas de maíz, tan queridas por los escolares, son bienvenidas como material de investigación, ya que casi todas las papas y el maíz de los que se elaboran golosinas crujientes llevan genes extraños y es muy fácil identificar OGM en ellos. O bayas, por ejemplo, fresas, arándanos, pan con pipas de girasol. Pero es recomendable acordar previamente quién probará qué producto, porque los KIT para extracción de ADN están diseñados para ciertos productos y, por ejemplo, el que se usa en este caso no implica el aislamiento de ADN de harina, aceite, condimentos, copos de maíz, etc.
En los experimentos que he descrito, se aisló ADN de arándanos, pepinos y semillas de girasol.
Características distintivas de este estudio:
- Prepesado de la muestra (1 g) y trituración minuciosa con mortero. La molienda es necesaria para destruir las paredes celulares bastante densas de las plantas (lo que no hacen las células animales).
- Aislamiento con una Matriz InstaGene homogeneizada (aunque por supuesto se puede usar un detergente) sin la adición de proteasas (destrucción de proteínas celulares) y sin precipitación de ADN con sales, ya que la sal ya está en InstaGene.
- No hay sorbente en KIT, por lo tanto, sin elución; en principio, los niños no pueden prestar atención a esto.
¿Por qué se utilizó InstaGene Matrix en principio? Porque esta es una forma bastante rápida de aislar el ADN, en 15-20 minutos, lo que ahorra mucho tiempo de clase. InstaGene también quela iones divalentes (p. Ej., Mg2), que son necesarios para las enzimas que destruyen el ADN (p. Ej., DNasa).
3. Realización de la reacción en cadena de la polimerasa
Después del aislamiento exitoso del ADN de los alimentos por parte de los niños, de acuerdo con los protocolos del fabricante, se preparan mezclas de PCR para 6 tubos Eppendorf de acuerdo con la Tabla 1 (10-15 minutos).

Enlace
Después de eso, termina la primera parte del experimento. El profesor coloca los tubos en el amplificador él mismo y establece los modos de amplificación de acuerdo con el protocolo.
Segunda lección
4. Electroforesis en gel y discusión (40-45 minutos) Los
niños preparan un gel de agarosa al 3% en tampón TAE. Mientras dura la electroforesis (200 V 20 minutos), puede discutir las opciones probables para los resultados (Figura 2). Y después de recibir las fotos, comenta los posibles errores.

Figura 2. Posibles resultados de la prueba
Referencia
Por ejemplo, en el grupo de niños que probaron pepinos, no se observaron amplicones (Figura 3).

Figura 3. Imagen de gel de electroforesis de muestra (pepino)
⁕ - controles (- sin OMG, + que contiene OMG); T - muestra de prueba; M - marcador de peso molecular; PMM - cebador del fotosistema II; OMG es una base para OMG.
Discusión sobre los resultados de 1 muestra:en este caso, no se agregaron cebadores a la mezcla de amplificación.
La segunda experiencia es probar el ADN de las semillas de girasol (Figura 4).
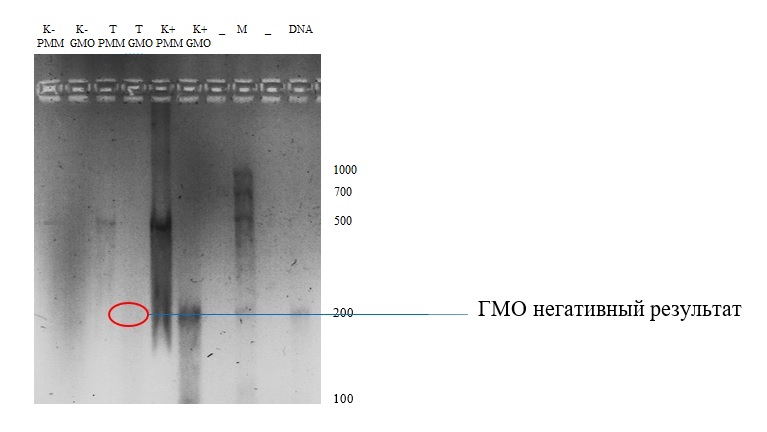
Figura 4. Imagen en gel de electroforesis, muestra de semilla de girasol
⁕ - controles (- no contiene OMG, + contiene OMG); T - muestra de prueba; M - marcador de peso molecular; PMM - cebador del fotosistema II; OMG es una base para OMG.
Discusión sobre los resultados de la 2a muestra:el control negativo (bolsa de gel 2), en cuyo genoma no había genes modificados, no contiene amplicones. Esto indica que el cebador no reconoció la región de secuenciación del promotor 35S y el terminador NOS. Se observó el patrón opuesto con la detección de un amplicón de aproximadamente 200 pares de bases en la sexta bolsa de gel (control positivo - control modificado genéticamente). Visualmente, solo se obtuvo un producto de amplificación con una longitud de aproximadamente 200 pb en el OGM de control positivo (bolsa de gel 6), pero los productos de amplificación del promotor y el terminador eran casi del mismo tamaño (203 pb y 225 pb, respectivamente (BioRad)), por lo que que podemos suponer que hay dos productos de amplificación en la bolsa de gel 6.En la mayoría de los estudios, el promotor 35S y el terminador NOS son los más utilizados y pueden utilizarse para detectar genes modificados en más del 85% de los casos. Este método es suficiente para responder a la pregunta de si el promotor y / o terminador anterior estaba presente, pero este método no es suficiente para responder qué genes se insertaron.
Los amplicones específicos del gen del cloroplasto del fotosistema II se pueden encontrar en las 3 muestras de alimentos (bolsas 1, 3, 5), tanto las que contienen genes modificados como las que no contienen genes modificados. Las muestras estudiadas no contenían los amplicones del terminador NOS o del promotor 35S (bolsillo 4). A pesar de que el experimento se llevó a cabo con éxito y los estudiantes recibieron un resultado inequívoco, la foto no es del todo clara, como si estuviera nublada. Dado que este fenómeno se extendió a todo el gel, se puede concluir que se produjo contaminación durante la preparación de tampón TAE 1x. Probablemente fue material de vidrio contaminado en el laboratorio.
La última experiencia está probando arándanos (Figura 5).

Figura 5. Electroforesis de imagen en gel de una muestra de arándano
⁕ - controles (- no contiene OMG, + contiene OMG); T - muestra de prueba; M - marcador de peso molecular; PMM - cebador del fotosistema II; OMG es una base para OMG.
Discusión sobre los resultados de 3 muestras: después de ejecutar el gel, el gel de agarosa se ve de arriba a abajo. Las 3 muestras de alimentos contienen amplicones característicos del gen del cloroplasto del fotosistema II. Se puede ver una banda en el control negativo (con cebadores transgénicos), ya que este es un control genéticamente libre, esto es muy extraño. No se esperaban amplicones de aproximadamente 200 pares de bases. Banda de 200 pb también aparece en la muestra de prueba (arándano) y en el control positivo. Esto indica que el cebador reconoció el sitio de secuenciación del promotor 35S del terminador NOS.
Pero la razón por la que la prueba de una muestra de arándanos resultó positiva (genéticamente modificada) puede deberse al hecho de que los arándanos son una especie de planta transgénica natural.
La muestra en estudio es probablemente un ejemplo de la interferencia de un organismo con otro organismo utilizando bacterias del suelo (tumefaciens). Tatyana Matveeva, Doctora en Ciencias Biológicas, Profesora del Instituto de Genética y Biotecnología de la Facultad de Biología de la Universidad Estatal de San Petersburgo ya ha identificado un ejemplo de transferencia transgénica natural en los arándanos. Ella y sus colegas del instituto han compilado un catálogo mundial de plantas con genomas ya secuenciados. De las 275 especies de plantas estudiadas, 23 eran transgenes naturales. Incluye cultivar de maní, cultivar de nuez, lúpulo, frutas tropicales de guayaba, flores de clavo, cerezas de Surinam, arándanos y arándanos. (Matveeva, 2019).
Por lo tanto, se asume que el arándano estudiado es un transgén natural.
5. 2
Parece que realizar la PCR es simple, pero la resolución de problemas puede ser más difícil si no se obtiene el amplicón deseado o si surgen fragmentos inespecíficos. La mayoría de las veces estamos hablando de cristalería contaminada en el laboratorio. Para evitar la contaminación de los reactivos y los métodos de PCR, se debe tener cuidado de utilizar puntas de pipeta nuevas para cada proceso de pipeteo. Además, tiene sentido cambiarse los guantes con más frecuencia mientras trabaja. Además, las soluciones y recipientes de reacción nuevos y esterilizados siempre deben usarse y etiquetarse adecuadamente para rastrear claramente la contaminación. Puede haber muchas razones por las que la PCR no funciona. Se deben observar varios parámetros químicos y físicos para una PCR exitosa. Desafortunadamente, sucede muy a menudo que después de la PCR no es posible obtener los resultados deseados.
Dado que incluso las cantidades más pequeñas de ADN pueden detectarse mediante PCR, es extremadamente importante evitar la contaminación de las mezclas de reacción de PCR con productos de PCR de experimentos anteriores o "ADN extraño" de otras fuentes.
Salir
La experiencia en la detección de OGM en los alimentos está destinada a adquirir habilidades prácticas para realizar la reacción en cadena de la polimerasa. A pesar de que se propone un plan de sinopsis, diseñado para 2 lecciones, la pausa entre las cuales es de al menos un día, sin embargo, el escenario típico queda a criterio del profesor. Las secciones analíticas de este estudio están diseñadas para guiar a los alumnos a través del proceso de descubrimiento y comprensión de conceptos que son relevantes para los procedimientos y el análisis de datos en cada etapa del viaje. Se espera que este enfoque (en comparación con el docente que proporciona a los estudiantes toda la información básica) hará que todo el estudio sea más comprensible para un mayor número de estudiantes. Siempre que el profesor tenga la oportunidad de comprobar el progreso y el nivel de comprensión de cada grupo (durante 2 lecciones),cierto grado de independencia es posible si se desea. Este enfoque permite que más alumnos adquieran las habilidades deseadas como se definió anteriormente.
Lista de literatura usada:
- bio-rad, „www.bio-rad.com,“ 03 de febrero de 2020. [En línea]
- Matveeva T., Ottem L. (2019). Ocurrencia generalizada de transformación genética natural de plantas por Agrobacterium. Biología Molecular Vegetal, 101, 415-437. DOI: 10.1007 / s11103-019-00913-y